2021年是党和国家历史上具有里程碑意义的一年。以习近平同志为核心的党中央团结带领全党全国各族人民,隆重庆祝中国共产党成立一百周年,胜利召开党的十九届六中全会、制定党的第三个历史决议,如期打赢脱贫攻坚战,如期全面建成小康社会、实现第一个百年奋斗目标,开启全面建设社会主义现代化国家、向第二个百年奋斗目标进军新征程。在“十四五”开局之年,作为我国负责药品注册上市的专职技术审评机构,国家药品监督管理局药品审评中心(以下简称药审中心)始终坚决贯彻落实习近平总书记重要讲话和重要指示精神,全面践行“四个最严”要求,牢记保护和促进公众健康初心使命,坚持人民至上、生命至上和科学审评,积极投身药品审评审批制度改革事业,紧紧围绕人民生命健康、世界科技前沿、国家重大需求等战略目标,在体制机制、技术标准、流程管理、队伍建设等方面加快创新融合步伐。
面对复杂严峻的疫情防控形势和极为艰巨繁重的药品审评任务,药审中心在国家药品监督管理局党组的坚强领导下,以习近平新时代中国特色社会主义思想为指导,深入学习贯彻党的十九届五中、六中全会精神和“七一”重要讲话精神,认真落实党中央、国务院决策部署,推动全面从严治党不断向纵深发展,认真开展好党史学习教育和“我为群众办实事”实践活动,全力推进新冠病毒疫苗药物应急审评审批,推动2款国产新冠病毒疫苗接连被纳入世界卫生组织(WHO)紧急使用清单(EUL),应急审评通过一组新冠病毒中和抗体联合治疗药物上市,着力建设公开透明的审评机制,多措并举支持儿童用药研发创新,人民获得感、幸福感、安全感显著增强。
2021年审评通过47个创新药,再创历史新高,临床急需境外新药上市持续加快,优先审评效率大幅提高,仿制药质量和疗效一致性评价工作扎实推进,临床试验管理跃上新台阶,核查检验协调机制更加通畅,实施药品电子通用技术文档申报,中国上市药品专利信息登记平台建设运行,完成中药“三方”抗疫成果转化,完善符合中医药特点的审评技术标准体系,支持和推动中药传承创新发展,持续深化ICH工作,保障国家药品监督管理局成功连任ICH管理委员会成员,发布87个技术指导原则,审评标准体系更加完备,流程导向审评体系更加科学,审评体系和审评能力现代化建设持续推进,医药产业创新能力和高质量发展进一步增强。
第一章 药品注册申请受理情况
(一)总体情况
1.全年受理情况
2021年,国家药品监督管理局药品审评中心(以下简称药审中心)受理注册申请11658件1,同比增长13.79%。
受理需技术审评的注册申请9235件,同比增长29.11%,包括需经技术审评后报送国家局2审批(以下简称技术审评)的注册申请2180件,需经技术审评后以国家局名义作出行政审批(以下简称审评审批)的注册申请7051件,需经技术审评后送国家药品监督管理局医疗器械技术审评中心、以医疗器械作用为主的药械组合(以下简称药械组合)产品的注册申请4件。
受理无需技术审评直接以国家局名义作出行政审批3(以下简称直接审批)的注册申请2423件。2017-2021年注册申请受理量详见图1。
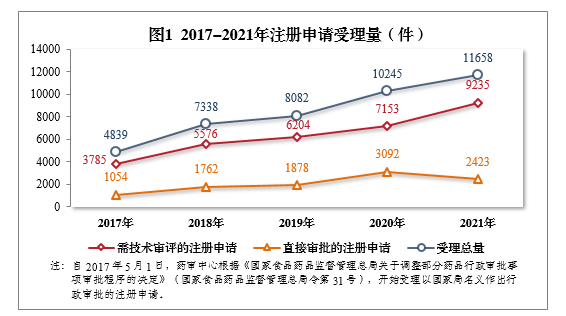
根据《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告》(2019年第56号,以下简称56号公告)要求,2021年受理原料药注册申请1313件,同比增长2.98%。
2.需技术审评的各类注册申请受理情况
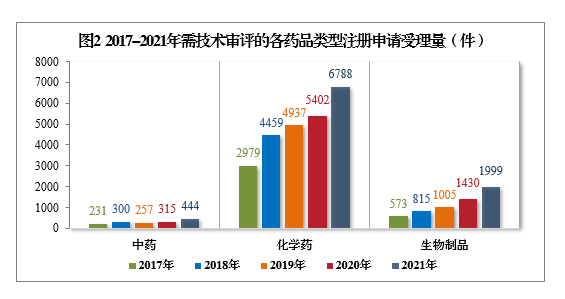
2021年受理的需技术审评的9231件4注册申请中,以药品类型统计,中药5注册申请444件,同比增长40.95%;化学药注册申请为6788件,同比增长25.66%,占全部需技术审评的注册申请受理量的73.53%;生物制品注册申请1999件,同比增长39.79%。2017-2021年需技术审评的各药品类型注册申请受理量详见图2。
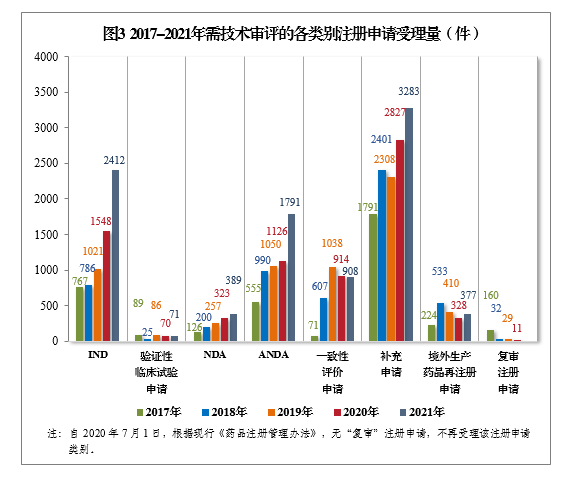
以注册申请类别统计,受理新药临床试验申请(该注册申请类别以下简称IND)2412件,同比增长55.81%;新药上市许可申请(该注册申请类别以下简称NDA)389件,同比增长20.43%;同名同方药、仿制药、生物类似药上市许可申请(该注册申请类别以下简称ANDA)1791件,同比增长59.06%;仿制药质量和疗效一致性评价注册申请6(该注册申请类别以下简称一致性评价申请)908件;补充申请3283件,同比增长16.13%。2017-2021年需技术审评的各类别注册申请受理量详见图3。
(二)创新药注册申请受理情况
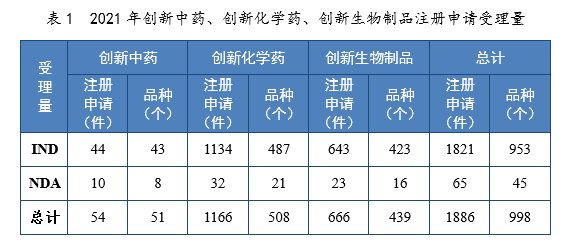
2021年受理创新药7注册申请1886件(998个品种8),同比增长76.10%。
以药品类型统计,创新中药54件(51个品种),同比增长134.78%;创新化学药1166件(508个品种),同比增长55.05%;创新生物制品666件(439个品种),同比增长125.00%。
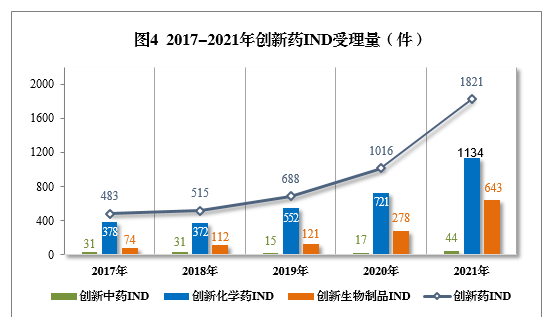
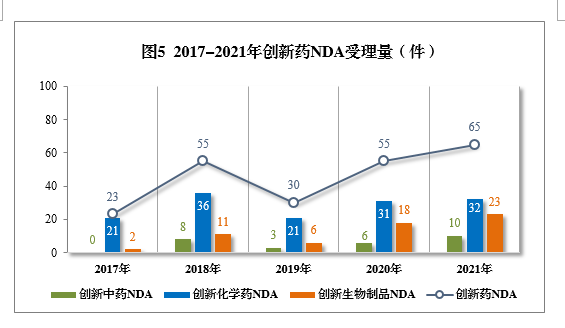
以注册申请类别统计,IND 1821件(953个品种),同比增长79.23%;NDA 65件(45个品种),同比增长18.18%。
2021年创新中药、创新化学药、创新生物制品注册申请受理量详见表1,2017-2021年创新药IND受理量详见图4,2017-2021年创新药NDA受理量详见图5。
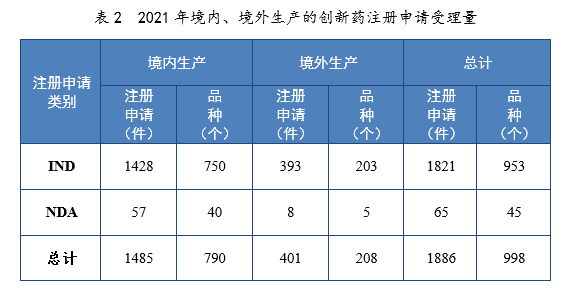
以生产场地类别统计,境内生产创新药1485件(790个品种),境外生产创新药401件(208个品种)。2021年境内、境外生产的创新药注册申请受理量详见表2。
(三)需技术审评的中药注册申请受理情况
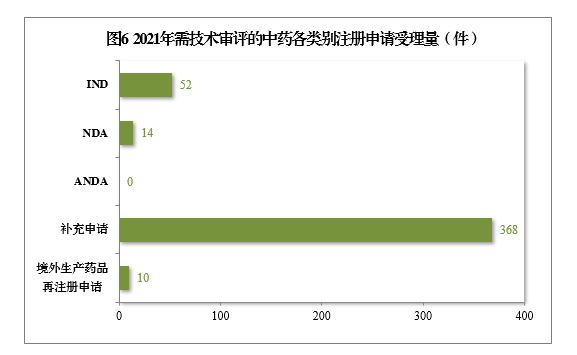
2021年受理需技术审评的中药注册申请444件。以注册申请类别统计,IND
52件,同比增长136.36%,包括创新中药IND 44件(43个品种),同比增长158.82%;NDA
14件,同比增长133.33%,包括创新中药NDA 10件(8个品种),同比增长66.67%。
2021年需技术审评的中药各类别注册申请受理量详见图6。2017-2021年需技术审评的中药各类别注册申请受理量详见图7。
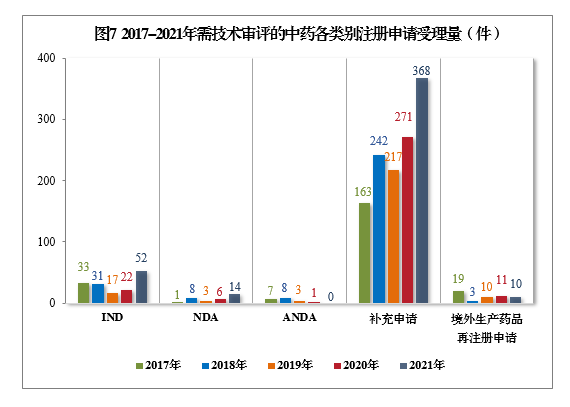
(四)需技术审评的化学药注册申请受理情况
2021年受理需技术审评的化学药注册申请6788件。以注册申请类别统计,IND
1500件,同比增长58.56%,包括创新化学药IND 1134件(487个品种),同比增长57.28%;NDA
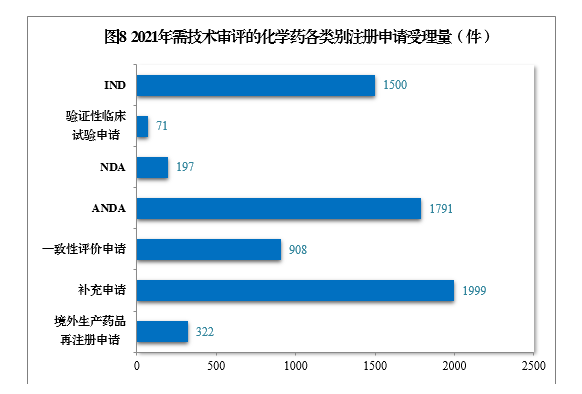
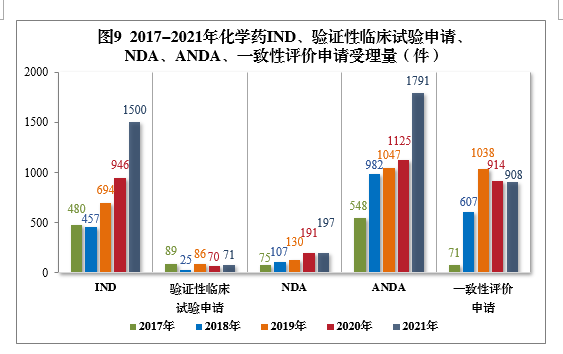
197件,同比增长3.14%,包括创新化学药NDA 32件(21个品种),同比增长3.23%;化学药5.1类9注册申请169件,同比增长5.63%,其中临床试验申请10共44件,NDA 125件;ANDA 1791件,同比增长59.20%;一致性评价申请908件。
2021年需技术审评的化学药各类别注册申请受理量详见图8。2017-2021年化学药IND、验证性临床试验申请、NDA、ANDA、一致性评价申请受理量详见图9。
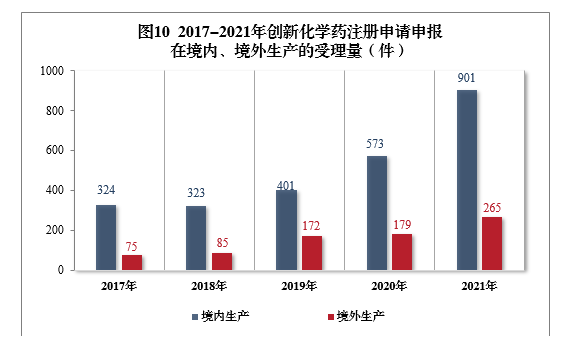
需技术审评的创新化学药注册申请共1166件(508个品种)11中,以生产场地类别统计,901件(385个品种)申报在境内生产,265件(123个品种)申报在境外生产。2017-2021年创新化学药注册申请申报在境内、境外生产的受理量详见图10。
(五)需技术审评的生物制品注册申请受理情况
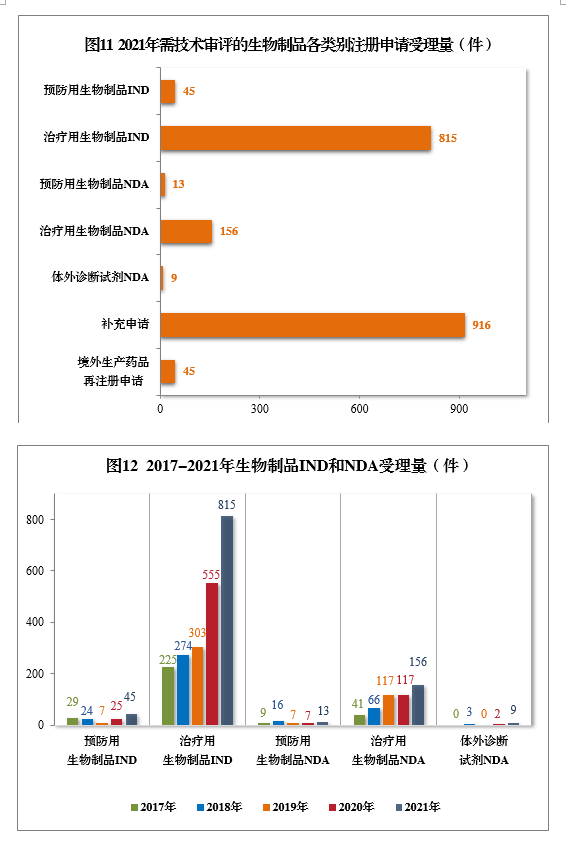
2021年受理需技术审评的生物制品注册申请1999件,其中,预防用生物制品注册申请229件、治疗用生物制品注册申请1755件和体外诊断试剂15件。以注册申请类别统计:
IND
860件,同比增长48.28%,包括创新生物制品IND 643件(423个品种),同比增长131.29%。其中,预防用生物制品IND
45件,包括创新预防用生物制品IND 26件(16个品种),治疗用生物制品IND 815件,包括创新治疗用生物制品IND
617件(407个品种)。
NDA 178件,同比增长41.27%,包括创新生物制品NDA
23件(16个品种),同比增长27.78%。其中,预防用生物制品NDA 13件,包括创新预防用生物制品NDA
5件(2个品种);治疗用生物制品NDA 156件,包括创新治疗用生物制品18件(14个品种);体外诊断试剂9件。
补充申请916件。境外生产药品再注册申请45件。
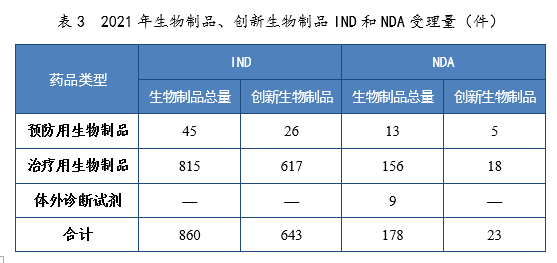
2021年生物制品、创新生物制品IND和NDA受理量详见表3。2021年需技术审评的生物制品各类别注册申请受理量详见图11。2017-2021年生物制品IND和NDA受理量详见图12。
表3 2021年生物制品、创新生物制品IND和NDA受理量(件)
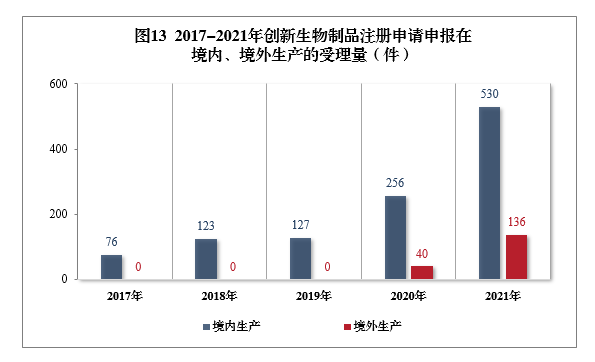
需技术审评的创新生物制品注册申请共666件(439个品种12)中,以生产场地类别统计,境内生产创新生物制品注册申请530件(354个品种),境外生产创新生物制品注册申请136件(85个品种)。2017-2021年创新生物制品注册申请申报在境内、境外生产的受理量详见图13。
(六)行政审批注册申请受理情况
1.总体情况
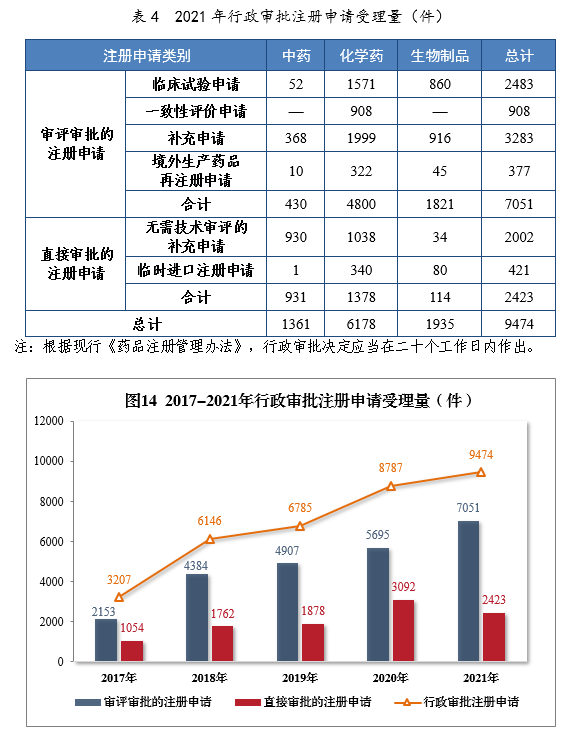
2021年受理行政审批注册申请9474件,同比增长7.82%。其中,直接审批的注册申请2423件;审评审批的注册申请137051件,同比增长23.81%,包括临床试验申请2483件,同比增长53.46%。
2021年行政审批注册申请受理量详见表4。201714-2021年行政审批注册申请受理量详见图14。
2.审评审批的注册申请受理情况
2021年受理审评审批的注册申请7051件,以药品类型统计,中药注册申请430件,同比增长40.07%;化学药注册申请4800件,同比增长17.50%,占全部审评审批的注册申请受理量的68.08%;生物制品注册申请1821件,同比增长39.75%。
以注册申请类别统计,临床试验申请2483件,同比增长53.46%;一致性评价申请908件;补充申请3283件,同比增长16.13%;境外生产药品再注册申请377件,同比增长14.94%。
3.直接审批的注册申请受理情况
2021年受理直接审批的注册申请2423件,以药品类型统计,中药注册申请931件、化学药注册申请1378件、生物制品注册申请114件。以注册申请类别统计,补充申请2002件、临时进口注册申请421件。
第二章 药品注册申请审评审批情况
(一)总体情况
1.全年审评审批工作情况
2021年审结的15注册申请共12083件16,同比增长19.55%。
审结的需技术审评的注册申请9679件,同比增长35.66%,包括技术审评的注册申请2632件,审评审批的注册申请7039件,药械组合注册申请8件。
审结直接审批的注册申请2404件。2017-2021年注册申请审结量详见图15。
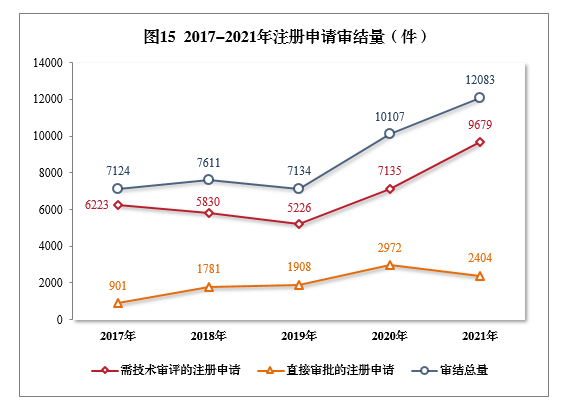
截至2021年底,有5652件注册申请正在审评审批中;待申请人回复补充资料1353件。根据56号公告,2021年审结原料药注册申请494件。截至2021年底,有1302件原料药注册申请正在审评审批中;待申请人回复补充资料582件。
2.需技术审评的各类注册申请审结情况
2021年审结的需技术审评的9671件17注册申请中,以药品类型统计,中药注册申请456件,同比增长22.25%;化学药注册申请7295件,同比增长34.22%,占全部需技术审评审结量的75.43%;生物制品注册申请1920件,同比增长45.12%。
2017-2021年需技术审评的各药品类型注册申请审结量详见图16。
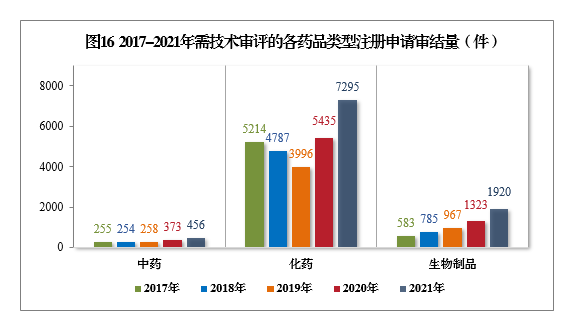
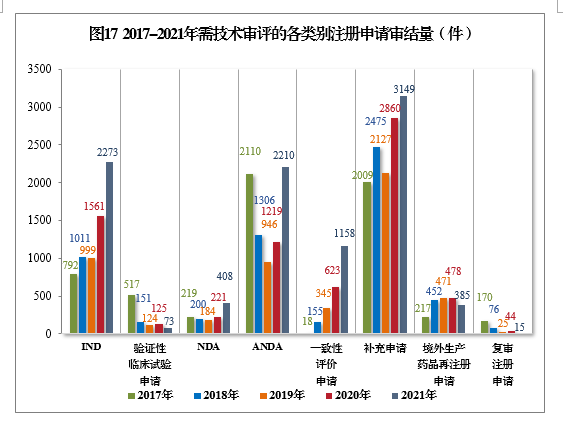
以注册申请类别统计,IND 2273件,同比增长45.61%;NDA 408件,同比增长84.62%;ANDA 2210件,同比增长81.30%;一致性评价申请1158件,同比增长85.87%;补充申请3149件,同比增长10.10%。2017-2021年需技术审评的各类别注册申请审结量详见图17。
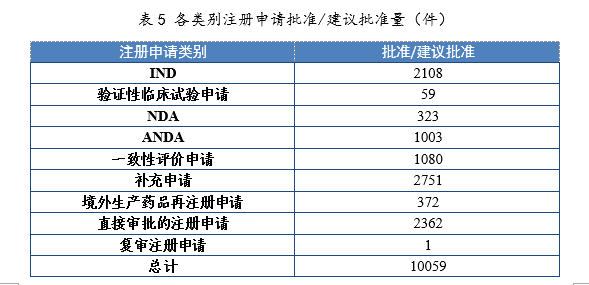
3.批准/建议批准情况
2021年批准IND
2108件,同比增长46.90%;建议批准NDA 323件(见附件1),同比增长55.29%;建议批准ANDA
1003件,同比增长9.26%;批准一致性评价申请1080件,同比增长87.18%。各类别注册申请批准/建议批准量详见表5。
建议批准境外生产原研药1876个品种(含新增适应症品种,见附件2)。
临床急需境外新药81个品种19中,截至2021年底,已有54个品种提出注册申请,51个品种获批上市,按审评时限审结率(以下简称按时限审结率)100%,临床急需境外新药审评审批情况见附件3。
4.各类别注册申请按时限审结情况
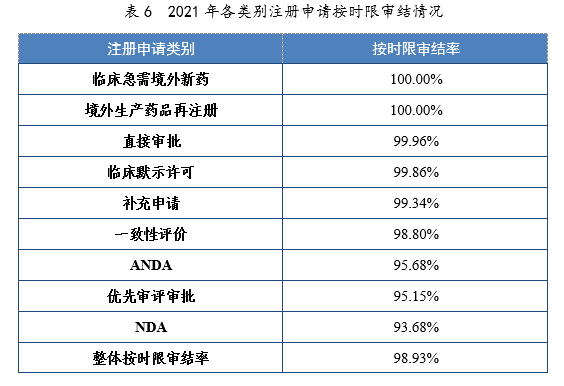
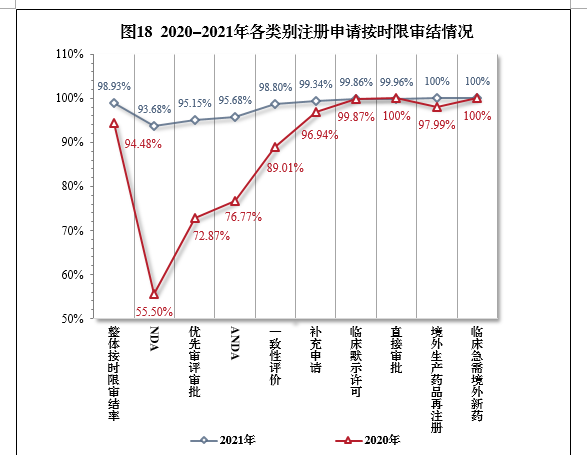
2021年,药审中心持续优化审评流程、严格审评时限管理、加快审评速度、强化项目督导,全年整体按时限审结率98.93%。其中NDA、ANDA、纳入优先审评审批程序的注册申请按时限审结率均超过90%,取得历史性突破。2021年各类别注册申请按时限审结情况详见表6,2020-2021年各类别注册申请按时限审结情况详见图18。
(二)创新药注册申请审结情况
1.总体情况
2021年审结创新药20注册申请1744件(943个品种),同比增长67.85%。
以药品类型统计,创新中药55件(55个品种),同比增长52.78%;创新化学药1085件(484个品种),同比增长45.44%;创新生物制品604件(404个品种),同比增长135.02%。
以注册申请类别统计,IND 1663件(885个品种),同比增长67.14%;NDA 81件(58个品种),同比增长84.09%。
2.批准/建议批准情况
2021年批准/建议批准创新药注册申请1628件(878个品种),同比增长67.32%。
以药品类型统计,创新中药39件(39个品种),同比增长39.29%;创新化学药1029件(463个品种),同比增长44.32%;创新生物制品560件(376个品种),同比增长141.38%。以注册申请类别统计,IND
1559件(831个品种),同比增长65.32%,NDA 69件(47个品种,见附件4),同比增长130.00%。
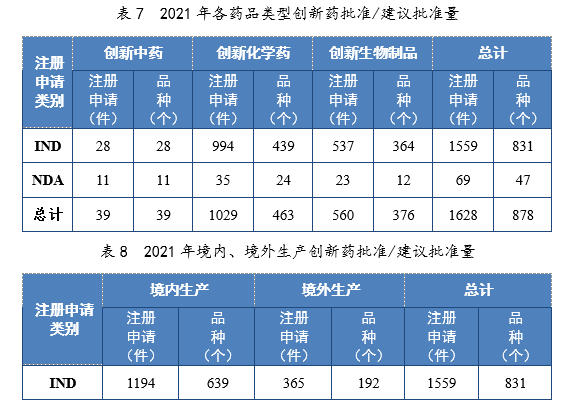
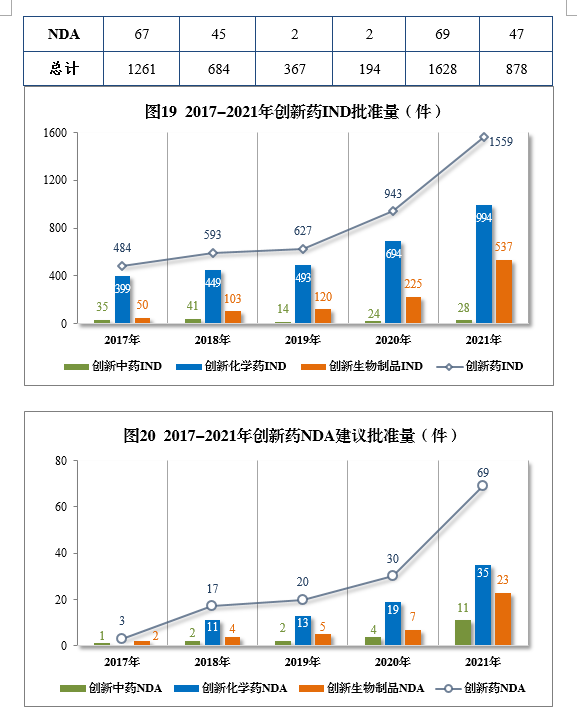
以生产场地类别统计,境内生产创新药1261件(684个品种),同比增长60.84%;境外生产创新药367件(194个品种),同比增长94.18%。2021年各药品类型创新药批准/建议批准量详见表7,2021年境内、境外生产创新药批准/建议批准量详见表8,2017-2021年创新药IND批准量详见图19,2017-2021年创新药NDA建议批准量详见图20。
(三)需技术审评的中药注册申请审结情况
1.总体情况
2021年审结需技术审评的中药注册申请456件,同比增长22.25%。以注册申请类别统计,IND 49件,同比增长32.43%;NDA 19件,同比增长216.67%;ANDA 3件。2021年需技术审评的中药各类别注册申请审结量详见图21。
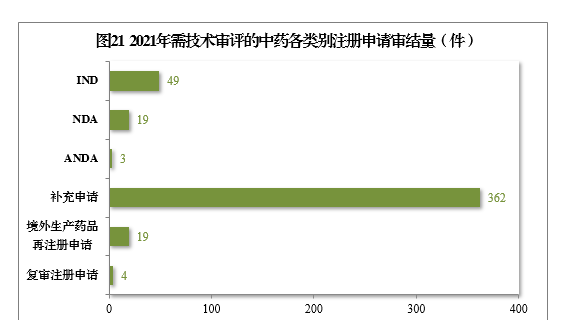
2.批准/建议批准情况
2021年审结的中药IND中,批准34件,不批准9件。审结的中药NDA中,建议批准14件,建议不批准3件。2021年需技术审评的中药注册申请审结情况详见表9。
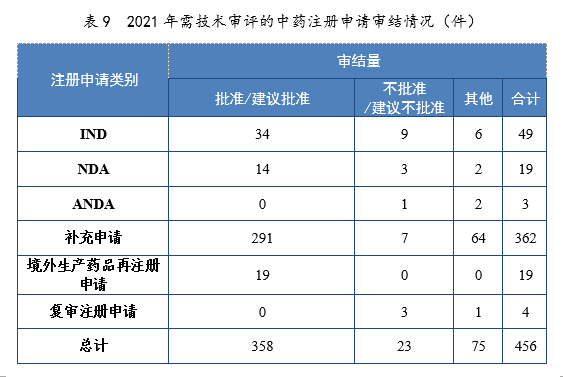
注:“其他”是指申请人未按规定缴纳费用、撤回申请等原因导致审评审批终止的情形。
批准中药IND
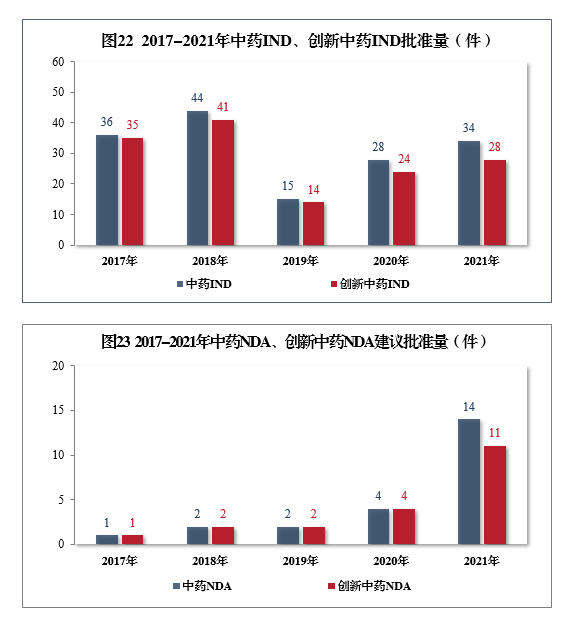
34件,同比增长21.43%,包括创新中药IND 28件(28个品种),同比增长16.67%;建议批准中药NDA
14件,同比增长250.00%,创5年以来新高,包括创新中药NDA
11件(11个品种),同比增长175.00%。2017-2021年中药IND、创新中药IND批准量详见图22,2017-2021年中药NDA、创新中药NDA建议批准量详见图23。
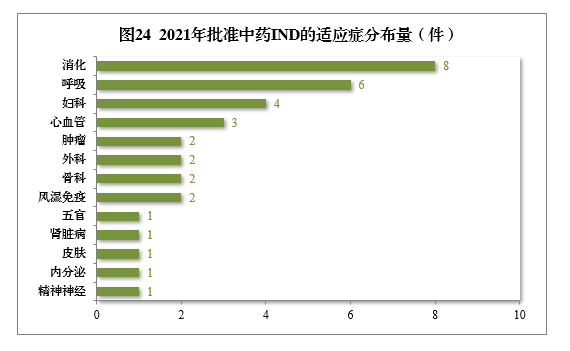
批准的34件中药IND中,涉及13个适应症领域,其中消化8件、呼吸6件、妇科4件,共占52.94%,2021年批准中药IND的适应症领域分布量详见图24。
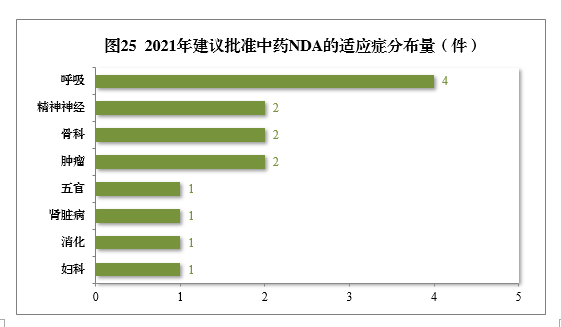
建议批准的中药NDA 14件中,呼吸肿瘤、精神神经、骨科药物较多,占全部中NDA批准量的71.43%。
2021年建议批准中药NDA的适应症分布量详见图25。
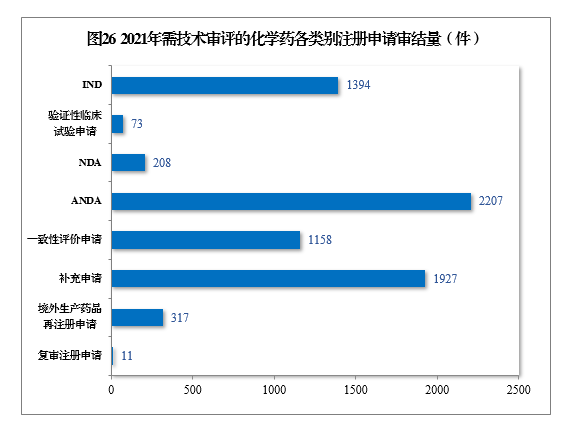
(四)需技术审评的化学药注册申请审结情况
1.总体情况
2021年审结需技术审评的化学药注册申请7295件。以注册申请类别统计,化学药临床试验申请1467件,同比增长35.21%;化学药NDA
208件,同比增长67.74%;化学药ANDA
2207件,同比增长81.50%;化学药一致性评价申请1158件,同比增长85.87%。2021年需技术审评的化学药各类别注册申请审结量详见图26。
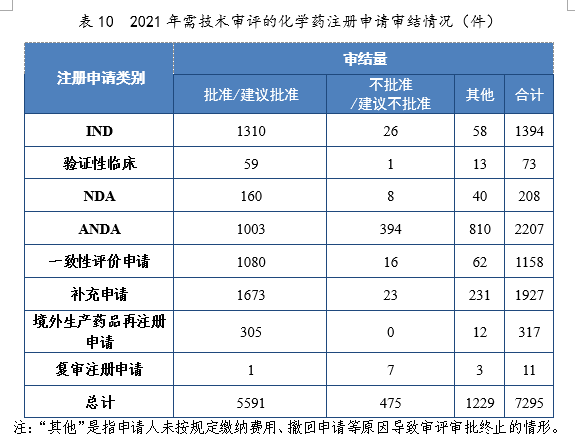
2.批准/建议批准情况
2021年审结的化学药IND中,批准1310件,不批准26件。审结的化学药NDA中,建议批准160件,建议不批准8件。审结的化学药ANDA中,建议批准1003件,建议不批准394件。2021年需技术审评的化学药注册申请审结情况详见表10。
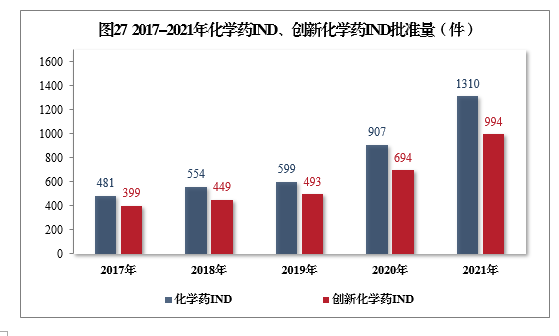
批准化学药IND 1310件,同比增长44.43%,其中创新化学药IND 994件(439个品种),同比增长43.23%。2017-2021年化学药IND、创新化学药IND批准量详见图27。
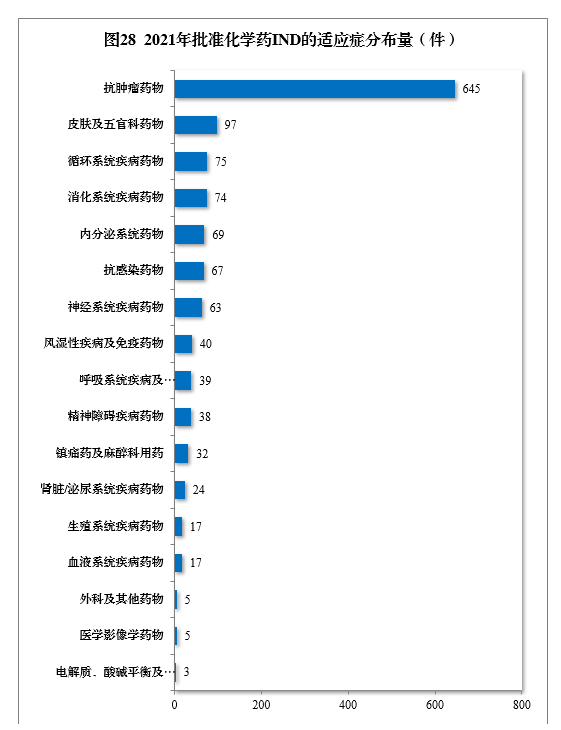
批准的化学药IND 1310件中,抗肿瘤药物、皮肤及五官科药物、循环系统疾病药物、消化系统疾病药物、内分泌系统药物、抗感染药物和神经系统疾病药物较多,占全部化学药IND批准量的83.21%。2021年批准化学药IND的适应症分布量详见图28。
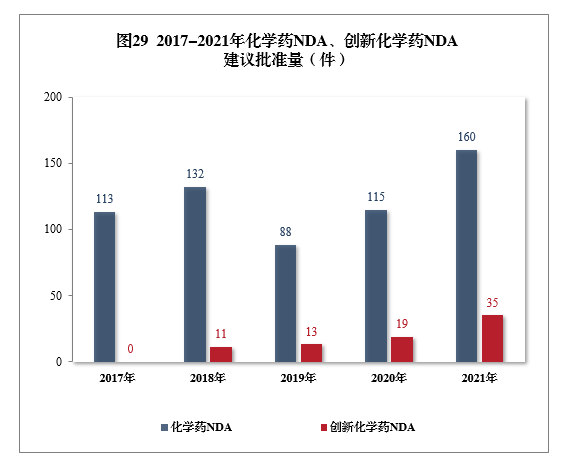
建议批准化学药NDA 160件,同比增长39.13%,包括创新化学药35件(24个品种),同比增长84.21%;建议批准化学药ANDA 1003件,同比增长9.26%。2017-2021年化学药NDA、创新化学药NDA建议批准量详见图29。
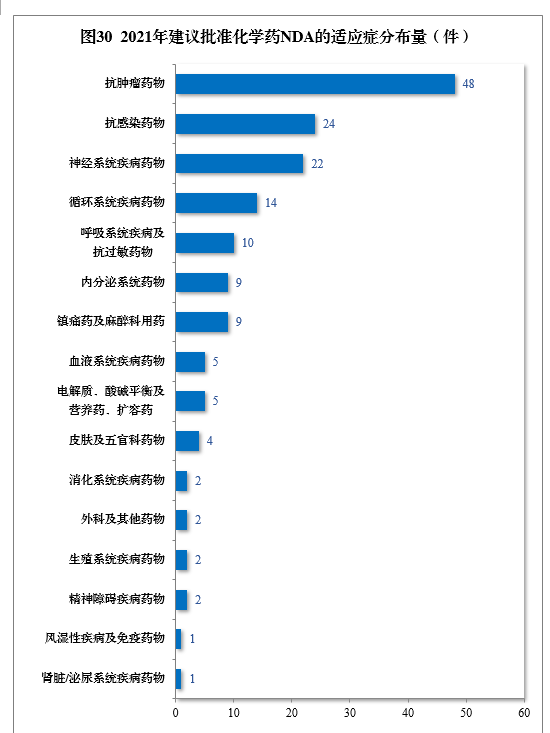
建议批准的化学药NDA 160件中,抗肿瘤药物、抗感染药物、神经系统疾病药物、循环系统疾病药物、呼吸系统疾病及抗过敏药物药物较多,占全部化学药NDA批准量的73.75%。2021年建议批准化学药NDA的适应症分布量详见图30。
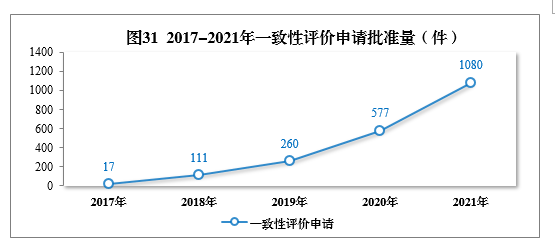
审结一致性评价申请共1158件,批准1080件。其中口服固体制剂一致性评价申请391件,注射剂一致性评价申请689件,2017-2021年一致性评价申请批准量详见图31。2021年批准的一致性评价品种见附件5。
(五)需技术审评的生物制品注册申请审结情况
1.总体情况
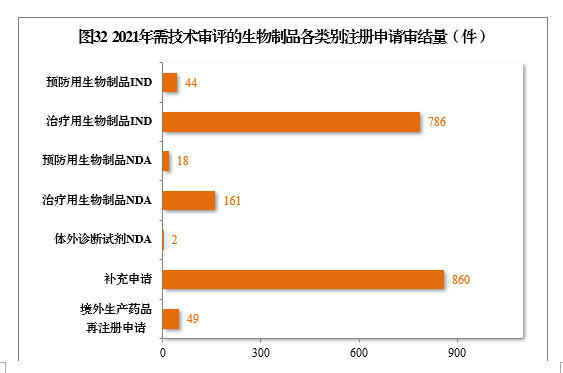
2021年,审结1920件需技术审评的生物制品注册申请,其中,预防用生物制品234件和治疗用生物制品1676件,体外诊断试剂10件。以注册申请类别统计,IND
830件,同比增长47.16%,NDA
181件,同比增长98.90%,补充申请860件,境外生产药品再注册申请49件。2021年需技术审评的生物制品各类别注册申请审结量详见图32。
2.批准/建议批准情况
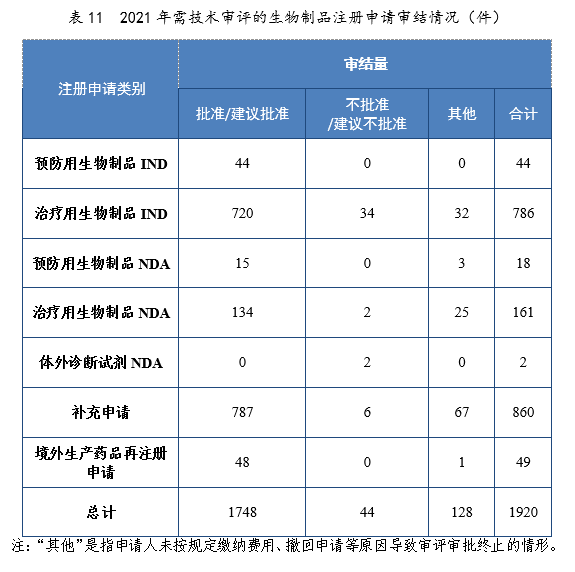
2021年审结的生物制品IND中,批准764件,不批准34件。审结的生物制品NDA中,建议批准149件,建议不批准4件。2021年需技术审评的生物制品注册申请审结情况详见表11。
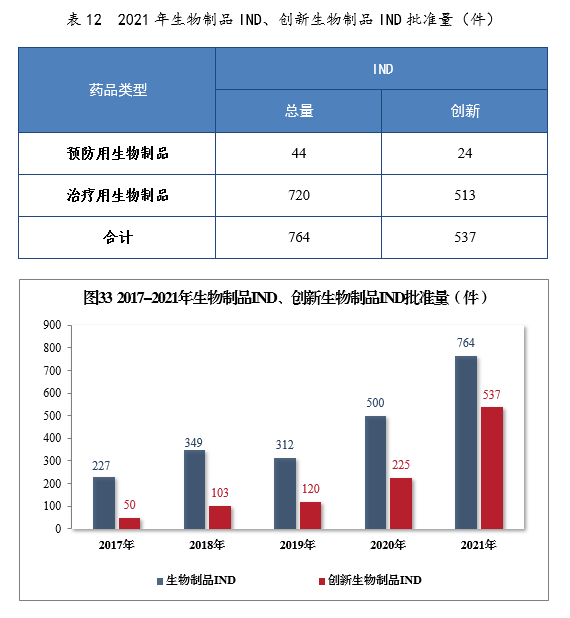
批准生物制品IND
764件,同比增长52.80%,包括创新生物制品IND 537件(364个品种),同比增长138.67%。其中,预防用生物制品IND
44件,同比增长131.58%,包括创新预防用生物制品IND 24件(16个品种),同比增长800%;治疗用生物制品IND
720件,同比增长49.69%,包括创新治疗用生物制品IND
513件(348个品种),同比增长131.08%。2021年生物制品IND、创新生物制品IND批准量详见表12。2017-2021年生物制品IND、创新生物制品IND批准量详见图33。
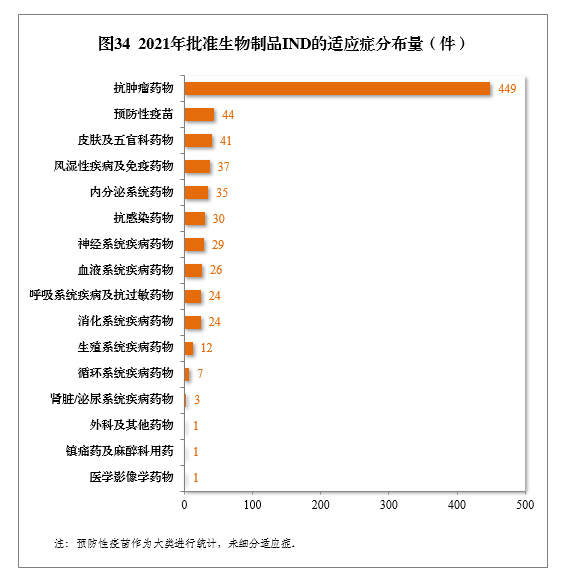
批准的生物制品IND 764件中,抗肿瘤药物较多,占全部生物制品IND批准量的58.77%。2021年批准生物制品IND的适应症分布量详见图34。
建议批准生物制品NDA 149件,同比增长67.42%,包括创新生物制品NDA 23件(12个品种),同比增长228.57%。其中,预防用生物制品NDA 15件,同比增长114.29%,包括创新预防用生物制品NDA 6件(3个品种);治疗用生物制品NDA 134件,同比增长65.43%,包括创新治疗用生物制品NDA 17件(9个品种),同比增长142.86%。2021年生物制品NDA、创新生物制品NDA建议批准量详见表13。2017-2021年生物制品NDA、创新生物制品NDA通过批准量详见图35。
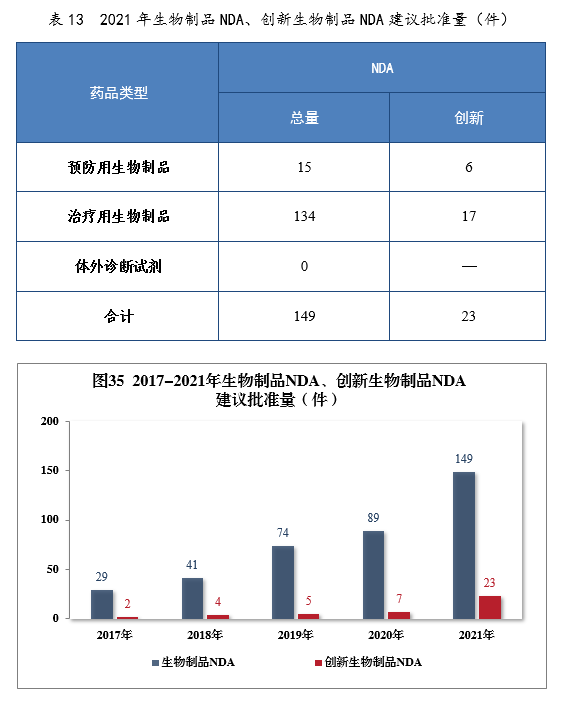
建议批准的生物制品NDA 149件中,抗肿瘤、血液系统、内分泌系统药物、疫苗较多,占全部生物制品NDA批准量的82.55%。2021年建议批准生物制品NDA的适应症分布量详见图36。
(六)行政审批注册申请审结情况
1.总体情况
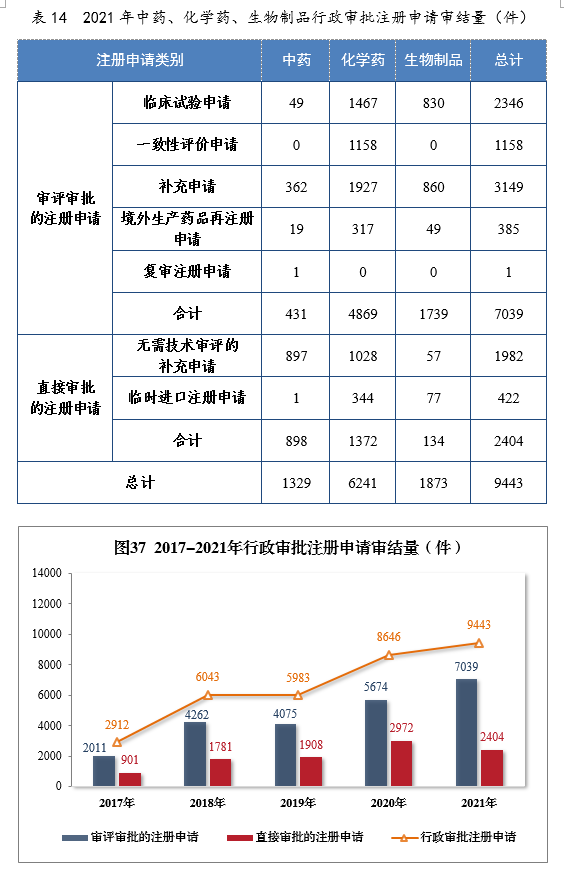
2021年审结行政审批注册申请9443件,同比增长9.22%。审评审批的注册申请217039件,同比增长24.06%;直接审批的注册申请222404件。2021年中药、化学药、生物制品行政审批注册申请审结量详见表14。2017-2021年需行政审批注册申请审结量详见图37。
2.审评审批的注册申请审结情况
审评审批的7039件注册申请中,以药品类型统计,中药注册申请431件,同比增长20.73%;化学药注册申请为4869件,同比增长19.16%,占全部审评审批审结量的69.17%;生物制品注册申请1739件,同比增长41.27%。以注册申请类别统计,临床试验申请2346件,同比增长39.15%;一致性评价申请1158件,同比增长85.87%;补充申请3149件,同比增长10.10%;境外生产药品再注册申请385件、复审注册申请1件。
3.直接审批的注册申请审结情况
直接审批的2404件注册申请中,以药品类型统计,中药注册申请898件、化学药注册申请1372件、生物制品注册申请134件。以注册申请类别统计,补充申请1982件、临时进口注册申请422件。
(七)药品注册核查情况
2021年合规审查8526件注册申请,以注册申请类别统计,NDA 617件,ANDA 2375件,一致性评价申请1687件,补充申请2423件,原料药注册申请1424件。
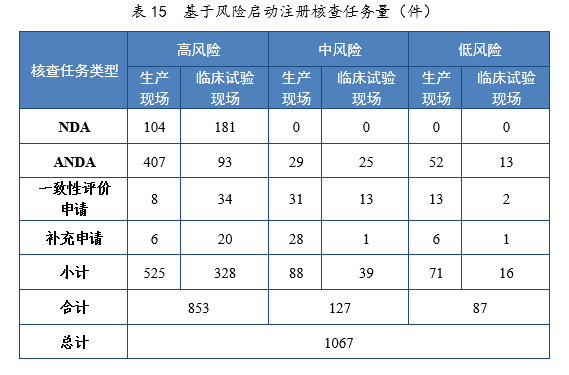
2021年基于风险共启动注册核查任务231067件,包括药品注册生产现场(以下简称生产现场)核查任务684件,药物临床试验现场(以下简称临床试验现场)核查任务383件;以注册申请类别统计,NDA核查任务285件,ANDA核查任务619件,一致性评价申请核查任务101件,补充申请核查任务62件。基于风险启动注册核查任务量详见表15。
此外,启动了新冠病毒治疗药物、新冠病毒疫苗的现场核查、有因检查34次。
2021年国家药品监督管理局食品药品审核查验中心共返回药审中心各类核查报告1165件。
第三章 药品加快上市注册程序和沟通交流情况
(一)药品加快上市注册程序情况
1.突破性治疗药物程序
2021年受理的注册申请中,申请适用突破性治疗药物程序的注册申请263件。经综合评估、公示,53件(41个品种)纳入突破性治疗药物程序,覆盖了新型冠状病毒感染引起的疾病、非小细胞肺癌、卵巢癌等适应症。2021年药审中心突破性治疗药物程序纳入情况详见附件6。2021年建议批准的NDA中,有5件被纳入了突破性治疗药物程序得以加快上市。
2.附条件批准程序
2021年建议批准的323件NDA中,共有60件(38个品种)经附条件批准后上市,占比18.58%。2021年新药上市许可的附条件批准情况详见附件1。
3.优先审评审批程序
根据现行《药品注册管理办法》,2021年共115件注册申请(69个品种)纳入优先审评审批程序。其中,符合附条件批准的药品41件,占比35.65%,符合儿童生理特征的儿童用药品新品种、剂型和规格34件,占比29.57%。药审中心优先审评资源逐年加大向具有临床优势的新药、儿童用药、罕见病药物注册申请倾斜。
2020-2021年根据现行《药品注册管理办法》纳入优先审评审批程序的注册申请量详见表16。
表16 2020-2021年根据现行《药品注册管理办法》纳入优先审评审批程序的注册申请量(件)
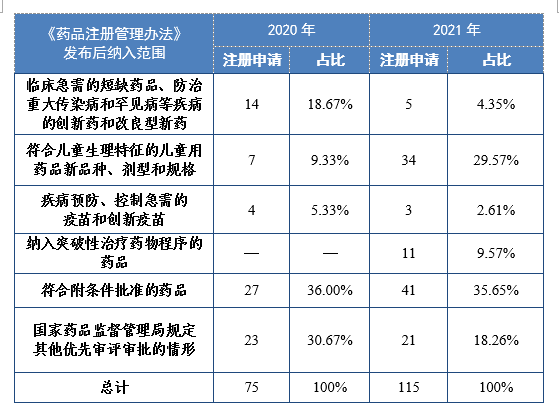
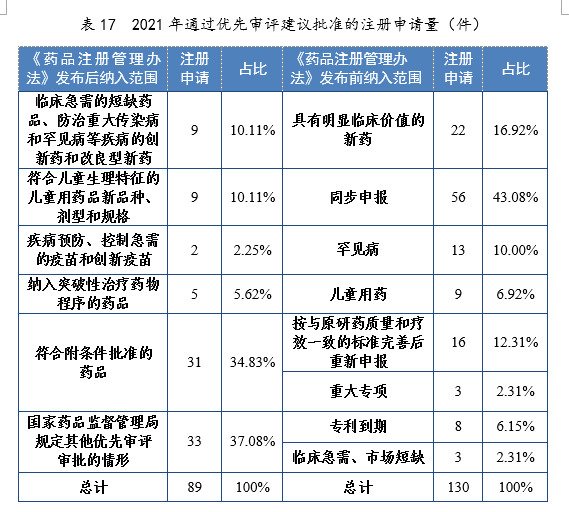
已纳入优先审评审批程序的注册申请中,2021年有219件(131个品种)建议批准上市。按照现行《药品注册管理办法》发布前纳入范围,130件注册申请已纳入优先审评审批程序,其中同步申报的注册申请56件,占比43.08%,具有明显临床价值的新药22件,占比19.92%;按照现行《药品注册管理办法》发布后纳入范围,89件注册申请已纳入优先审评审批程序,其中符合附条件批准的药品31件,占比34.83%,符合儿童生理特征的儿童用药品新品种、剂型和规格9件,占比10.11%。2021年通过优先审评建议批准的注册申请量详见表17。
4.特别审批程序
2021年审结81件纳入特别审批程序的注册申请(新冠病毒疫苗和治疗药物),其中,批准新冠病毒疫苗IND
12件,建议批准新冠病毒疫苗NDA
5件(均为附条件批准上市),分别为4件新型冠状病毒灭活疫苗(Vero细胞)、1件重组新型冠状病毒疫苗(5型腺病毒载体);批准新冠病毒治疗药物IND
15件,分别为小分子抗病毒药物4件,中和抗体9件,其他类药物2件;建议批准新冠病毒治疗药物NDA
5件,分别为清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒、新冠病毒中和抗体联合治疗药物安巴韦单抗注射液(BRII-196)及罗米司韦单抗注射液(BRII-198);批准涉及新冠病毒相关补充申请44件。
(二)与申请人沟通交流情况
药审中心不断调整沟通交流和咨询方式,以适应疫情防控常态化和申请人逐年增长的沟通交流需求。目前,药审中心与申请人沟通交流和咨询的方式主要有:召开沟通交流会议、药审中心网站(申请人之窗)一般性技术问题咨询、电话咨询、邮件咨询等。
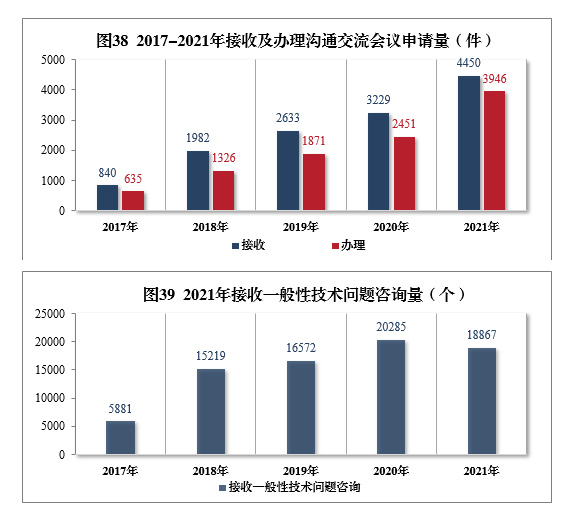
2021年接收沟通交流会议申请4450件,同比增长37.81%,办理沟通交流会议申请3946件,同比增长61.00%。接收一般性技术问题咨询18867个,办理一般性技术问题咨询18423个;办理电话咨询一万余次,8个联系邮箱24咨询近万次,2017-2021年接收及办理沟通交流会议申请量详见图38,2021年接收一般性技术问题咨询量详见图39。
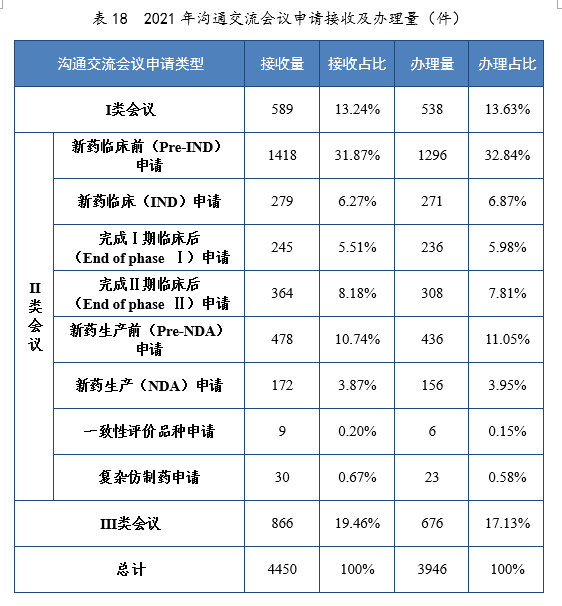
2.沟通交流会议办理情况
2021年接收沟通交流会议申请4450件。经综合评估,符合沟通交流会议召开条件的,及时与申请人取得联系,商议会议细节;无需召开沟通交流会议的,以书面形式尽快回复申请人。2021年办理沟通交流会议申请3946件,在药物研发关键阶段召开的Ⅱ类会议69.23%,其中新药临床前(Pre-IND)申请32.84%,新药生产前(Pre-NDA)申请11.05%。2021年沟通交流会议申请接收及办理量详见表18。
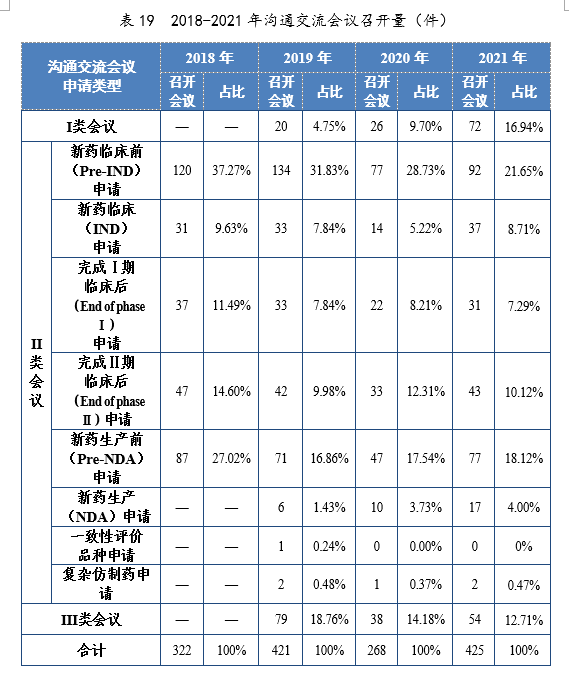
2021年召开沟通交流会议(面对面会议、视频会议和电话会议)425次,同比增长58.58%。Ⅱ类会议占比70.35%,其中新药临床前(Pre-IND)申请占比21.65%;新药生产前(Pre-IND)申请占比18.12%。2018-2021年沟通交流会议召开量详见表19。
第四章 药品注册申请存在的主要问题及分析
2021年,药品注册申请经技术审评后审评结论为不批准/建议不批准的注册申请542件,其中,359件属于因申请人未能在规定时限内补充资料的情形,占全年不批准/建议不批准总量的66.3%,包括中药9件、化学药349件、生物制品1件;183件注册申请主要存在申报资料无法证明申请注册药品的安全性、有效性或质量可控性等缺陷问题,包括中药14件、化学药126件、生物制品43件。
(一)主要问题
1.研发立题方面
这方面问题主要存在于早期开发品种(IND阶段)和某些仿制药及补充申请的开发立项阶段。具体包括:药物研发的临床定位不清,适应症选择不合理;剂型或给药途径选择不合理;已有研究数据提示药效作用不明显,作用靶点和机制不清晰,成药性风险高;联合用药违背临床诊疗和用药原则,或缺乏有效性和安全性研究数据支持;已有的研究数据不支持已上市品种的改良开发;仿制药研发的参比制剂因安全有效性问题已撤市;补充申请变更事项缺乏科学性和合理性。
2.有效性方面
这方面问题在上市注册申请中比较常见。具体包括:已有的临床研究数据尚无法证明品种的有效性;已开展的临床研究存在试验方案或者研究质量控制问题,无法评价受试品种的有效性;仿制药人体生物等效性试验结果表明和参比制剂不等效;化学药注册分类第3类的上市注册申请缺乏境内有效性临床数据。
3.安全性方面
药物安全性方面问题存在于药物开发的各个阶段。具体包括:早期(IND阶段)研究结果提示毒性明显或者安全窗过于狭窄,难以进入临床开发或提示应用于临床可能综合获益非常有限;临床前安全性研究方法或研究质量控制问题,或者研究数据不充分,不足以支持后续临床开发;已有的临床研究数据显示存在严重不良反应,临床应用获益和风险比值不合理;化学药注册分类第3类的上市注册申请缺乏境内安全性临床数据。
4.质量可控性方面
这方面问题常见于仿制药的开发。具体包括:药学研究存在严重缺陷,无法证明产品的质量可控性;申报资料无法证明仿制药与参比制剂质量的一致性;各开发阶段的研究受试样品不一致;样品稳定性研究结果、原料药起始物料选择等不符合仿制药上市技术要求;仿制药未按规定使用具有合法来源的原料药;样品复核检验不符合规定或检验方法存在严重缺陷。
5.合规性方面
这方面问题常见于经注册核查和注册检验的注册申请。具体包括:注册核查中发现研究数据存在真实性问题;注册核查中发现其他影响产品质量的重大缺陷;注册核查抽样检验不合格。
6.其他方面
具体包括:未按沟通交流时监管方提出的要求和标准提供研究数据或补充完善研究项目;审评中发现研究内容缺项,无法支持注册申请事项;药品说明书修订补充申请不符合说明书撰写要求和管理规范;用于支持变更补充申请的文献依据或者研究数据支持不足。
(二)与往年情况的比较
总体上看,2021年注册申请存在的主要问题,在分类、具体表现等方面与往年具有较大的相似性。但也出现了一些变化,主要包括:
1.出现的新问题
申请人未按在临床试验申请前沟通交流时监管方提出的补充资料要求提交研究资料,导致审评过程中发现IND研究内容缺项。根据现行《药品注册管理办法》第八十八条规定,申请人在药物临床试验申请的审评期间不得补充新的技术资料,致使审评不通过。
上述情况主要由于申请人未注意依据现行《药品注册管理办法》在审评期间不得补充新的技术资料,在提交注册申请资料时忽视了沟通交流中已明确的应提交的研究资料。此类情形是过往导致无法获批的原因中很少见到的。
2.基于某些问题而不批准的品种数量发生变化
一是2021年没有出现因未进行沟通交流而不批准的注册申请;二是因缺乏境内有效性、安全性临床数据而未获批准的化学药注册分类第3类上市注册申请数量较往年明显增加;三是因合规性问题而未获批准的注册申请数量较往年有减少趋势;四是开发立题合理性问题未获批准的注册申请数量增加趋势明显。
上述情况和注册申请过程中沟通交流管理要求,以及现行《药品注册管理办法》实施后化学药注册分类第3类上市注册申请审评结论管理要求的调整有关。
(三)启示和建议
对近期注册申请存在的主要问题进行梳理分析,可以从中得到启示,并为参与药物研发、注册、监管的各方提供参考建议。
1.充分重视药物开发立题依据
药物开发应立足于临床需求,尤其应重视解决未被满足的临床需求问题;应以临床价值为导向,充分重视同类创新药开发的优势问题,避免群体化、低水平、重复性创新;应充分评估改良型新药的临床价值和优势;变更补充申请应遵循必要性与合理性原则等。
2.利用好沟通交流机制
在已有的沟通交流机制下,申请人除了在药物开发过程的各关键节点提出沟通交流申请,还可以加强在研发其他环节和审评审批过程中的沟通交流;沟通交流应基于问题,解决问题,就关注的问题达成共识,消除信息不对等,不宜将沟通交流和行政审批程序等同起来;对于沟通交流达成的共识,各方应予以充分遵循。
3.加强创新药物开发的前期基础研究
某些新机制、新靶点宜做充分的成药性评估,开展尽可能多的概念验证研究,以降低后续开发风险,以免造成研究资源浪费;创新药商业开发策略应建立在科学性基础上,重视成药性证据链的完整性;应遵循药物开发的科学逻辑,循序渐进,尽量减少非科学因素对开发进程的干扰。
第五章 重点治疗领域品种
新冠病毒疫苗和新冠肺炎治疗药物:
1-2.新型冠状病毒灭活疫苗(Vero细胞)(北京科兴中维生物技术有限公司)、新型冠状病毒灭活疫苗(Vero细胞)(国药集团中国生物武汉生物制品研究所有限责任公司),适用于预防新型冠状病毒感染所致的疾病(COVID-19)。
3.重组新型冠状病毒疫苗(5型腺病毒载体),为首家获批的国产腺病毒载体新冠病毒疫苗,适用于预防由新型冠状病毒感染引起的疾病(COVID-19)。
4-6.清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒,即“三方”品种,为《新型冠状病毒肺炎诊疗方案(试行第九版)》推荐药物,清肺排毒颗粒用于感受寒湿疫毒所致的疫病,化湿败毒颗粒用于湿毒侵肺所致的疫病,宣肺败毒颗粒用于湿毒郁肺所致的疫病。“三方”品种均来源于古代经典名方,是新冠肺炎疫情暴发以来,在武汉抗疫临床一线众多院士专家筛选出有效方药清肺排毒汤、化湿败毒方、宣肺败毒方的成果转化,也是《国家药监局关于发布〈中药注册分类及申报资料要求〉的通告》(2020年第68号)后首次按照“中药注册分类
3.2类
其他来源于古代经典名方的中药复方制剂”审评审批的品种。“三方”品种的获批上市为新冠肺炎治疗提供了更多选择,充分发挥了中医药在疫情防控中的作用。
7-8.安巴韦单抗注射液(BRII-196)、罗米司韦单抗注射液(BRII-198),为我国首家获批拥有自主知识产权新冠病毒中和抗体联合治疗药物,上述两个药品可治疗新型冠状病毒肺炎(COVID-19),联合用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12—17岁,体重≥40kg)新型冠状病毒感染(COVID-19)患者,其中,青少年(12—17岁,体重≥40kg)适应症人群为附条件批准,其获批上市为新冠肺炎治疗提供了更多选择。
中药新药:
9.益气通窍丸,具有益气固表,散风通窍的功效,适用于治疗对季节性过敏性鼻炎中医辨证属肺脾气虚证。本品为黄芪、防风等14种药味组成的原6类中药新药复方制剂,在中医临床经验方基础上进行研制,开展了随机、双盲、安慰剂平行对照、多中心临床试验,其获批上市为季节性过敏性鼻炎患者提供了一种新的治疗选择。
10.益肾养心安神片,功能主治为益肾、养心、安神,适用于治疗失眠症中医辨证属心血亏虚、肾精不足证,症见失眠、多梦、心悸、神疲乏力、健忘、头晕、腰膝酸软等,舌淡红苔薄白,脉沉细或细弱。本品为炒酸枣仁、制何首乌等10种药味组成的原6类中药新药复方制剂,在中医临床经验方基础上进行研制,开展了随机、双盲、安慰剂平行对照、多中心临床试验,其获批上市为失眠症患者提供了一种新的治疗选择。
11.银翘清热片,功能主治为辛凉解表,清热解毒,适用于治疗外感风热型普通感冒,症见发热、咽痛、恶风、鼻塞、流涕、头痛、全身酸痛、汗出、咳嗽、口干,舌红、脉数。本品为金银花、葛根等9种药味组成的1.1类中药创新药,在中医临床经验方基础上进行研制,开展了多中心、随机、双盲、安慰剂/阳性药平行对照临床试验,其获批上市为外感风热型普通感冒患者提供了一种新的治疗选择。
12.玄七健骨片,具有活血舒筋,通脉止痛,补肾健骨的功效,适用于治疗轻中度膝骨关节炎中医辨证属筋脉瘀滞证的症状改善。本品为延胡索、全蝎等11种药味组成的1.1类中药创新药,基于中医临床经验方基础上进行研制,通过开展随机、双盲、安慰剂平行对照、多中心临床试验,获得安全性、有效性证据,其获批上市将为患者提供一种新的治疗选择。
13.芪蛭益肾胶囊,具有益气养阴,化瘀通络的功效,适用于治疗早期糖尿病肾病气阴两虚证。本品为黄芪、地黄等10种药味组成的1.1类中药创新药,基于中医临床经验方基础上进行研制,通过开展随机、双盲、安慰剂平行对照、多中心临床试验,获得安全性、有效性证据,其获批上市将为患者提供新的治疗选择。
14.坤心宁颗粒,具有温阳养阴,益肾平肝的功效,适用于治疗女性更年期综合征中医辨证属肾阴阳两虚证。本品为地黄、石决明等7种药味组成的1.1类中药创新药,基于中医临床经验方基础上进行研制,通过开展随机、双盲、安慰剂平行对照、多中心临床试验,获得安全性、有效性证据,其获批上市将为患者提供新的治疗选择。
15.虎贞清风胶囊,具有清热利湿,化瘀利浊,滋补肝肾的功效,适用于治疗轻中度急性痛风性关节炎中医辨证属湿热蕴结证。本品为虎杖、车前草等4种药味组成的1.1类中药创新药,在中医临床经验方基础上进行研制,开展了随机、双盲、安慰剂平行对照、多中心临床试验,获得安全性、有效性证据,其获批上市将为患者提供新的治疗选择。
16.解郁除烦胶囊,具有解郁化痰、清热除烦的功效,适用于治疗轻、中度抑郁症中医辨证属气郁痰阻、郁火内扰证。本品种为栀子、姜厚朴等8种药味组成的1.1类中药创新药,在中医临床经验方基础上进行研制,处方根据中医经典著作《金匮要略》记载的半夏厚朴汤和《伤寒论》记载的栀子厚朴汤化裁而来,开展了随机、双盲、阳性对照药(化学药品)、安慰剂平行对照、多中心临床试验,获得安全性、有效性证据,其获批上市将为患者提供新的治疗选择。
17.七蕊胃舒胶囊,具有活血化瘀,燥湿止痛的功效,适用于治疗轻中度慢性非萎缩性胃炎伴糜烂湿热瘀阻证所致的胃脘疼痛。本品为三七、枯矾等4种药味组成的1.1类中药创新药,在医疗机构制剂基础上进行研制,开展了随机、双盲、阳性药平行对照、多中心临床试验,其获批上市为慢性胃炎患者提供了新的治疗选择。
18.淫羊藿素软胶囊,适用于治疗不适合或患者拒绝接受标准治疗、且既往未接受过全身系统性治疗的、不可切除的肝细胞癌,患者外周血复合标志物满足以下检测指标的至少两项:AFP≥400
ng/mL;TNF-α<2.5pg/mL;IFN-γ≥7.0pg/mL。本品为从中药材淫羊藿中提取制成的1.2类中药创新药,其获批上市为肝细胞癌患者提供了新的治疗选择。
罕见病药物:
19.布罗索尤单抗注射液,适用于治疗成人和1岁以上儿童患者的X连锁低磷血症(XLH)。X连锁低磷血症属罕见病,目前尚无有效治疗药物。本品种属临床急需境外新药名单品种,为以成纤维细胞生长因子23(FGF23)抗原为靶点的一种重组全人源IgG1单克隆抗体,可结合并抑制FGF23活性从而使血清磷水平增加,其获批上市为患者提供了新的治疗选择。
20.醋酸艾替班特注射液,适用于治疗成人、青少年和≥2岁儿童的遗传性血管性水肿急性发作。遗传性血管性水肿属罕见病,近半数患者会出现上呼吸道黏膜水肿,引发窒息进而危及生命,已被纳入国家卫生健康委员会等五部门联合公布的《第一批罕见病目录》。本品种属临床急需境外新药名单品种,为缓激肽B2受体的竞争性拮抗剂,其获批上市可为我国遗传性血管性水肿患者的预防发作提供安全有效的药物。
21.注射用艾诺凝血素α,适用于成人和儿童B型血友病(先天性IX因子缺乏)患者的以下治疗:按需治疗以及控制出血事件;围手术期的出血管理;常规预防,以降低出血事件的发生频率。血友病B属遗传性、出血性罕见病,目前国内尚无长效重组人凝血因子Ⅸ进口或上市。本品种属临床急需境外新药名单品种,为首个在国内申报进口的长效重组人凝血因子IX产品,其获批上市为患者提供了新的治疗选择。
22.注射用司妥昔单抗,适用于治疗人体免疫缺陷病毒(HIV)阴性和人疱疹病毒8型(HHV-8)阴性的多中心卡斯特曼病(MCD)成人患者。MCD是一种以淋巴组织生长为特征的罕见病,多数患者出现多器官损害且预后差,部分患者会转化为恶性淋巴瘤,已被纳入国家卫生健康委员会等五部门联合公布的《第一批罕见病目录》。本品种属临床急需境外新药名单品种,其获批上市为患者提供了治疗选择。
23.奥法妥木单抗注射液,适用于治疗成人复发型多发性硬化(RMS),包括临床孤立综合征、复发缓解型多发性硬化和活动性继发进展型多发性硬化。多发性硬化(MS)是免疫介导的慢性中枢神经系统疾病,已被纳入国家卫生健康委员会等五部门联合公布的《第一批罕见病目录》。本品为抗人CD20的全人源免疫球蛋白G1单克隆抗体,其获批上市为患者提供了治疗选择。
儿童用药:
24.利司扑兰口服溶液用散,适用于治疗2月龄及以上患者的脊髓性肌萎缩症(SMA)。SAM是由于运动神经元存活基因1(SMN1)突变导致SMN蛋白功能缺陷所致的遗传性神经肌肉病,是造成婴幼儿死亡的常染色体隐性遗传疾病之一,已被纳入国家卫生健康委员会等五部门联合公布的《第一批罕见病目录》。本品种为治疗儿童罕见病的1类创新药,可直接靶向疾病的潜在分子缺陷,增加中枢组织和外周组织的功能性SMN蛋白的产生,其获批上市可为SMA患者提供新的治疗选择。
25.达妥昔单抗β注射液,适用于治疗≥12月龄的高危神经母细胞瘤和伴或不伴有残留病灶的复发性或难治性神经母细胞瘤的儿童患者。神经母细胞瘤为儿童常见的恶性肿瘤之一,尚无免疫治疗产品获批上市。本品种属临床急需境外新药名单品种,其获批上市可丰富儿童患者的治疗选择。
26.顺铂注射液,此前已批准适用于小细胞与非小细胞肺癌、非精原细胞性生殖细胞癌、晚期难治性卵巢癌、晚期难治性膀胱癌、难治性头颈鳞状细胞癌、胃癌、食管癌的姑息治疗,此次新增批准了儿童用法用量,其获批上市保障了儿童临床合理用药。
27.盐酸氨溴索喷雾剂,适用于治疗2-6岁儿童的痰液粘稠及排痰困难。本品种为适合儿童使用剂型的改良型新药,相对于口服制剂,可以避免遗撒和呕吐,对于年龄小且不配合服药的儿童而言,具有更好的顺应性,其获批上市可丰富儿童患者的治疗选择。
28.盐酸头孢卡品酯颗粒,适用于儿童对头孢卡品敏感的菌所致的下列感染:皮肤软组织感染、淋巴管和淋巴节炎、慢性脓皮病;咽炎、喉炎、扁桃体炎(包括扁桃体周炎,扁桃体周脓肿)、急性支气管炎、肺炎;膀胱炎、肾盂肾炎;中耳炎、鼻窦炎;猩红热。本品种为第三代口服头孢菌素类抗菌药物,剂型具有较高的用药依从性,适合儿童尤其是婴幼儿使用,其获批上市可为儿童患者提供一种有效的治疗选择。
公共卫生用药:
29.四价流感病毒裂解疫苗,适用于3岁及以上人群预防疫苗相关型别的流感病毒引起的流行性感冒。本品种为使用世界卫生组织推荐的甲型(H1N1和H3N2)和乙型(B/Victoria和B/Yamagata)流行性感冒病毒株制成的裂解疫苗,国内既往使用的流感疫苗以三价流感病毒裂解疫苗为主,本品种在此基础上增加了一种乙型流感抗原,以增加对乙型流感的抗体保护率和阳转率,其获批上市有助于进一步缓解四价流感疫苗供不应求的矛盾。
30.ACYW135群脑膜炎球菌多糖结合疫苗(CRM197载体),适用于预防A群、C群、Y群和W135群脑膜炎奈瑟球菌引起的流行性脑脊髓膜炎。本品种为国内首个批准上市的四价脑膜炎多糖结合疫苗,其获批上市可填补国内2岁以下儿童无Y群、W135群脑膜炎多糖结合疫苗可用的空白。
31.冻干人用狂犬病疫苗(Vero细胞),适用于预防狂犬病。目前国内仅两家企业疫苗获批四剂免疫程序,其余均为五剂免疫程序,本品种同时申报五剂免疫程序和2-1-1四剂免疫程序,其获批上市可进一步缓解狂犬病疫苗市场短缺现象。
抗肿瘤药物:
32.甲磺酸伏美替尼片,适用于既往经EGFR酪氨酸激酶抑制剂治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR
T790M突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者的治疗。本品种是我国自主研发并拥有自主知识产权的1类创新药,为第三代表皮生长因子受体(EGFR)激酶抑制剂,其获批上市为患者提供了新的治疗选择。
33.普拉替尼胶囊,适用于既往接受过含铂化疗的转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者的治疗。本品为受体酪氨酸激酶RET(Rearranged
during
Transfection)抑制剂的1类创新药,可选择性抑制RET激酶活性,可剂量依赖性抑制RET及其下游分子磷酸化,有效抑制表达RET(野生型和多种突变型)的细胞增殖,其获批上市为患者提供了新的治疗选择。
34.赛沃替尼片,适用于治疗含铂化疗后疾病进展或不耐受标准含铂化疗的、具有间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌成人患者。本品种是我国拥有自主知识产权的1类创新药,为我国首个获批的特异性靶向MET激酶的小分子抑制剂,可选择性抑制MET激酶的磷酸化,对MET
14号外显子跳变的肿瘤细胞增殖有明显的抑制作用,其获批上市为患者提供了新的治疗选择。
35.舒格利单抗注射液,适用于联合培美曲塞和卡铂用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞状非小细胞肺癌患者的一线治疗,以及联合紫杉醇和卡铂用于转移性鳞状非小细胞肺癌患者的一线治疗。本品为重组抗PD-L1全人源单克隆抗体,可阻断PD-L1与T细胞上PD-1和免疫细胞上CD80间的相互作用,通过消除PD-L1对细胞毒性T细胞的免疫抑制作用,发挥抗肿瘤作用,其获批上市为患者提供了新的治疗选择。
36.优替德隆注射液,适用于联合卡培他滨,治疗既往接受过至少一种化疗方案的复发或转移性乳腺癌患者。本品种是我国自主研发并拥有自主知识产权的1类创新药,为埃坡霉素类衍生物,可促进微管蛋白聚合并稳定微管结构,诱导细胞凋亡,其获批上市为患者提供了新的治疗选择。
37.羟乙磺酸达尔西利片,适用于联合氟维司群,治疗既往接受内分泌治疗后出现疾病进展的激素受体阳性、人表皮生长因子受体2阴性的复发或转移性乳腺癌患者。本品种是一种周期蛋白依赖性激酶4和6(CDK4和CDK6)抑制剂的1类创新药,可降低CDK4和CDK6信号通路下游的视网膜母细胞瘤蛋白磷酸化水平,并诱导细胞G1期阻滞,从而抑制肿瘤细胞的增殖。其获批上市为患者提供了新的治疗选择。
38.帕米帕利胶囊,适用于既往经过二线及以上化疗的伴有胚系BRCA(gBRCA)突变的复发性晚期卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。本品种为PARP-1和PARP-2的强效、选择性抑制剂1类创新药,通过抑制肿瘤细胞DNA单链损伤的修复和同源重组修复缺陷,对肿瘤细胞起到合成致死的作用,尤其对携带BRCA基因突变的DNA修复缺陷型肿瘤细胞敏感度高。其获批上市为患者提供了新的治疗选择。
39.甲苯磺酸多纳非尼片,适用于既往未接受过全身系统性治疗的不可切除肝细胞癌患者。本品种是我国自主研发并拥有自主知识产权的1类创新药,为多激酶抑制剂类小分子抗肿瘤药物,其获批上市为患者提供了一种新的治疗选择。
40.注射用维迪西妥单抗,适用于至少接受过2种系统化疗的人表皮生长因子受体-2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。本品种为我国自主研发的创新抗体偶联药物(ADC),包含人表皮生长因子受体-2(HER2)抗体部分、连接子和细胞毒药物单甲基澳瑞他汀E(MMAE),其获批上市为患者提供了新的治疗选择。
41.阿基仑赛注射液,适用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者(包括弥漫性大B细胞淋巴瘤非特指型、原发纵膈大B细胞淋巴瘤、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的弥漫性大B细胞淋巴瘤)。本品种为我国首个批准上市的细胞治疗类产品,是一种自体免疫细胞注射剂,由携带CD19
CAR基因的逆转录病毒载体进行基因修饰的自体靶向人CD19嵌合抗原受体T细胞(CAR-T)制备,其获批上市为患者提供了新的治疗选择。
42.瑞基奥仑赛注射液,适用于治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤。本品种是我国首款自主研发的以及中国第二款获批上市的细胞治疗类产品,为靶向CD19的自体CAR-T细胞免疫治疗产品,其获批上市为患者提供了新的治疗选择。
43.奥雷巴替尼片,适用于治疗任何酪氨酸激酶抑制剂耐药,并采用经充分验证的检测方法诊断为伴有T315I突变的慢性髓细胞白血病慢性期或加速期的成年患者。本品种为我国自主研发并拥有自主知识产权的1类创新药,是小分子蛋白酪氨酸激酶抑制剂,可有效抑制Bcr-Abl酪氨酸激酶野生型及多种突变型的活性,可抑制Bcr-Abl酪氨酸激酶及下游蛋白STAT5和Crkl的磷酸化,阻断下游通路活化,诱导Bcr-Abl阳性、Bcr-Abl
T315I突变型细胞株的细胞周期阻滞和调亡,是国内首个获批伴有T315I突变的慢性髓细胞白血病适应症的药品,其获批上市为因T315I突变导致耐药的患者提供了有效的治疗手段。
44.恩沃利单抗注射液,适用于不可切除或转移性微卫星高度不稳定(MSI-H)或错配修复基因缺陷型(dMMR)的成人晚期实体瘤患者的治疗,包括既往经过氟尿嘧啶类、奥沙利铂和伊立替康治疗后出现疾病进展的晚期结直肠癌患者以及既往治疗后出现疾病进展且无满意替代治疗方案的其他晚期实体瘤患者。本品种为我国自主研发的创新PD-L1抗体药物,为重组人源化PD-L1单域抗体Fc融合蛋白注射液,可结合人PD-L1蛋白,并阻断其与受体PD-1的相互作用,解除肿瘤通过PD-1/PD-L1途径对T细胞的抑制作用,调动免疫系统的抗肿瘤活性杀伤肿瘤,其获批上市为患者提供了新的治疗选择。
抗感染药物:
45.阿兹夫定片,与核苷逆转录酶抑制剂及非核苷逆转录酶抑制剂联用,适用于治疗高病毒载量的成年HIV-1感染患者。本品种是新型核苷类逆转录酶和辅助蛋白Vif抑制剂的1类创新药,也是首个上述双靶点抗HIV-1药物,能够选择性进入HIV-1靶细胞外周血单核细胞中的CD4细胞或CD14细胞,发挥抑制病毒复制功能。其获批上市为HIV-1感染者提供了新的治疗选择。
46.艾诺韦林片,适用于与核苷类抗逆转录病毒药物联合使用,治疗成人HIV-1感染初治患者。本品种为HIV-1新型非核苷类逆转录酶抑制剂的1类创新药,通过非竞争性结合HIV-1逆转录酶抑制HIV-1的复制,其获批上市为HIV-1感染患者提供了新的治疗选择。
47.艾米替诺福韦片,适用于治疗慢性乙型肝炎成人患者。本品种是我国自主研发并拥有自主知识产权的1类创新药,为核苷类逆转录酶抑制剂,其获批上市为慢性乙型肝炎患者提供了新的治疗选择。
48-49.甲苯磺酸奥马环素片、注射用甲苯磺酸奥马环素,适用于治疗社区获得性细菌性肺炎(CABP)、急性细菌性皮肤和皮肤结构感染(ABSSSI)。甲苯磺酸奥马环素为新型四环素类抗菌药,具有广谱抗菌活性,以及口服和静脉输注两种剂型,其获批上市丰富了患者的治疗选择,提高了药品可及性。
50.康替唑胺片,适用于治疗对康替唑胺敏感的金黄色葡萄球菌(甲氧西林敏感和耐药的菌株)、化脓性链球菌或无乳链球菌引起的复杂性皮肤和软组织感染。本品种是我国自主研发并拥有自主知识产权的1类创新药,为全合成的新型噁唑烷酮类抗菌药,其获批上市为患者提供了新的治疗选择。
51.苹果酸奈诺沙星氯化钠注射液,适用于治疗对奈诺沙星敏感的肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌、副流感嗜血杆菌、卡他莫拉菌、肺炎克雷伯菌、铜绿假单胞菌以及肺炎支原体、肺炎衣原体和嗜肺军团菌所致的成人(≥18岁)社区获得性肺炎。本品种为无氟喹诺酮类抗菌药,与含氟喹诺酮类抗菌药具有不同的作用位点,其获批上市可为患者提供新的治疗选择。
52.注射用磷酸左奥硝唑酯二钠,适用于治疗肠道和肝脏严重的阿米巴病、奥硝唑敏感厌氧菌引起的手术后感染和预防外科手术导致的敏感厌氧菌感染。本品种属于最新一代硝基咪唑类抗感染药,其获批上市可为厌氧菌感染的治疗和预防提供新的治疗选择。
内分泌系统药物:
53.西格列他钠片,适用于配合饮食控制和运动,改善成人2型糖尿病患者的血糖控制。本品种是我国自主研发并拥有自主知识产权的1类创新药,为过氧化物酶体增殖物激活受体(PPAR)全激动剂,能同时激活PPAR三个亚型受体(α、γ和δ),并诱导下游与胰岛素敏感性、脂肪酸氧化、能量转化和脂质转运等功能相关的靶基因表达,抑制与胰岛素抵抗相关的PPARγ受体磷酸化,其获批上市为患者提供了新的治疗选择。
54.脯氨酸恒格列净片,适用于改善成人2型糖尿病患者的血糖控制。本品种是我国自主研发并拥有自主知识产权的1类创新药,为钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂,通过抑制SGLT2,减少肾小管滤过的葡萄糖的重吸收,降低葡萄糖的肾阈值,从而增加尿糖排泄。其获批上市为患者提供新的治疗选择。
循环系统药物:
55.海博麦布片,适用于作为饮食控制以外的辅助治疗,可单独或与HMG-CoA还原酶抑制剂(他汀类)联合用于治疗原发性(杂合子家族性或非家族性)高胆固醇血症,可降低总胆固醇、低密度脂蛋白胆固醇、载脂蛋白B水平。本品种为我国自主研发并拥有自主知识产权的1类创新药,可抑制甾醇载体Niemann-Pick
C1-like1(NPC1L1)依赖的胆固醇吸收,从而减少小肠中胆固醇向肝脏转运,降低血胆固醇水平,降低肝脏胆固醇贮量,其获批上市为原发性高胆固醇血症患者提供了新的治疗选择。
血液系统药物:
56.海曲泊帕乙醇胺片,适用于因血小板减少和临床条件导致出血风险增加的既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症成人患者,以及对免疫抑制治疗疗效不佳的重型再生障碍性贫血(SAA)成人患者。本品种是我国自主研发并拥有自主知识产权的1类创新药,为小分子人血小板生成素受体激动剂,其获批上市为患者提供了新的治疗选择。
风湿性疾病及免疫药物:
57.注射用泰它西普,适用于与常规治疗联合用于在常规治疗基础上仍具有高疾病活动的活动性、自身抗体阳性的系统性红斑狼疮(SLE)成年患者。本品种为我国自主研发的创新治疗用生物制品,可将B淋巴细胞刺激因子(BLyS)受体跨膜蛋白活化物(TACI)的胞外特定的可溶性部分,与人免疫球蛋白G1(IgG1)的可结晶片段(Fc)构建成的融合蛋白,由于TACI受体对BLyS和增殖诱导配体(APRIL)具有很高的亲和力,本品种可以阻止BLyS和APRIL与它们的细胞膜受体、B细胞成熟抗原、B细胞活化分子受体之间的相互作用,从而达到抑制BLyS和APRIL的生物学活性的作用,其获批上市为患者提供了新的治疗选择。
皮肤五官药物:
58.阿普米司特片,适用于治疗符合接受光疗或系统治疗指征的中度至重度斑块状银屑病的成人患者。本品种属临床急需境外新药名单品种,是磷酸二酯酶4(PDE4)小分子抑制剂,可以通过抑制PDE4促使细胞内环磷酸腺苷(cAMP)含量升高,从而增加抗炎细胞因子,并下调炎症反应,其获批上市可为患者提供一种给药便利的新型替代治疗选择。
第六章 高效做好应急审评
2021年,新冠肺炎疫情全球大流行仍处于发展阶段,病毒不断变异进一步增加了疫情的不确定性,我国疫情防控“外防输入、内防反弹”压力持续增大,人民群众对疫苗药品的期待不断增高,国际社会对我国疫苗药品安全的关注度与日俱增。在这种形势下,党和国家对新冠病毒疫苗药物审评审批工作不断提出更高要求,国务院副总理孙春兰、国务委员肖捷亲赴药审中心调研并召开座谈会。药审中心坚持人民至上、生命至上,尊重科学、遵循规律,以高效应对疫情形势变化的工作机制和举措,全力服务保障疫情防控工作大局,持续做好新冠病毒治疗药物、新冠病毒疫苗应急审评审批工作,交出了满意答卷。
(一)加速推动新冠病毒治疗药物研发上市
药审中心坚决有力落实孙春兰副总理、肖捷国务委员调研座谈会部署要求,严守新冠病毒治疗药物研发安全有效标准,加快重点药物应急审评审批,为应对突发公共卫生事件和新冠重大疫情提供科技保障。
一是第一时间学习传达调研座谈会议精神,研究贯彻落实措施,梳理新冠病毒药物应急审评工作进展情况,对重点品种按照“一药一策一团队”原则,逐个制定应急审评工作方案,建立工作机制,明确上市审评技术标准,确定上市审评工作节点,制定上市审评倒排时间表、路线图,形成《新冠药物上市审评工作方案》。
二是加强研审联动、主动指导企业,持续跟进新冠病毒治疗药物研发进展,对于已进入Ⅲ期临床试验或已获得初步临床试验数据提示临床终点获益的重点品种,依法依规做好新冠病毒药物审评工作,加快推动新冠病毒药物获批上市。同时密切关注国际上新冠病毒治疗药物研发、审评审批情况,做好知识储备,以便更好的指导进口药及国产仿制药研发及上市申报。
三是落实申请人主体责任,对于申请附条件批准上市的品种,督促申请人按照承诺按时完成相关研究并递交相关资料,做好新冠病毒治疗药物全生命周期科学监管。
四是在中药应急审评方面,药审中心第一时间调集中药技术审评骨干力量,形成新冠肺炎疫情中药应急审评专项工作小组,深入了解新冠肺炎病理特征、演变规律、中医证候和辨证施治的原则,紧跟抗疫一线中医药使用情况和研发动态,结合国家卫生健康委发布的《新型冠状病毒肺炎诊疗方案》,不断加深对中医药在新冠肺炎治疗中独特作用和临床需要的认识。
五是加强对申请人的技术指导和注册服务,随研发随提交,随提交随审评,大大缩短了审评时间,进一步优化了审评流程,累计完成84项立项申请的可行性评议工作,所有立项申请均在24小时内完成。在此基础上,全天候接受相关品种申请人在研发和整理申报资料过程中遇到的问题并坚持做到随到随答。按照“边审评、边研究、边总结”的工作模式,充分发挥以中医药院士和抗疫临床一线专家为主的特别专家组的指导作用,完成“三方”抗疫成果转化。
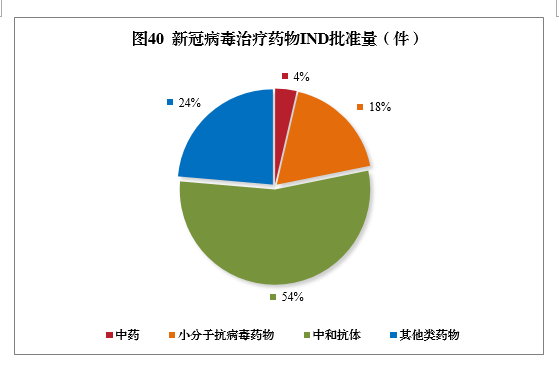
截至2021年底,累计批准55个品种新冠病毒治疗药物IND,包括中药2个,小分子抗病毒药物10个,中和抗体30个,其他类药物13个。2021年,新冠病毒中和抗体联合治疗药物(安巴韦单抗注射液、罗米司韦单抗注射液)、清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒已获批上市。新冠病毒治疗药物临床试验申请获批情况详见图40。
(二)坚持研审联动,创新工作模式,高效完成新冠病毒疫苗应急审评工作
药审中心深入贯彻落实党中央、国务院和国家局部署,持续优化“早期介入、持续跟踪、研审联动、科学审评”全天候应急审评审批工作机制,积极履职担当。
一是截至2021年底,加速推动4个新冠病毒疫苗附条件批准上市,5条技术路线的27个疫苗品种获批开展临床试验,其中9个进入Ⅲ期临床试验,新冠病毒疫苗审评取得重大突破。
二是主动服务疫苗企业,提供全程指导,与WHO积极沟通,全力支持2款国产新冠病毒疫苗纳入WHO紧急使用清单,取得历史性突破,为全面疫情防控、为企业复工复产、推动我国经济社会发展提供了重要保障,也为落实习近平总书记“疫苗作为全人类公共产品”的承诺提供了坚实支撑,展现了疫苗应急审评审批的“中国质量”和“大国担当”,为全球携手战胜疫情注入了强大信心。
三是积极推进新冠病毒疫苗扩产保质保供相关工作,创新工作模式,深入江苏、北京、安徽等地新冠病毒疫苗生产企业进行现场指导、现场办公,研究解决技术问题,高效完成扩产能应急审评工作,全面提升我国疫苗年产能达数十亿剂,扩大了疫苗的可及性和可负担性,有效地保障了人民群众的接种需求。
四是继续强化服务指导,持续跟进各技术路线新冠病毒疫苗研发进展,尤其是重点跟进重组蛋白类、核酸类新冠病毒疫苗临床试验进展情况,依法依规做好新冠病毒疫苗审评工作,推动更多新冠病毒疫苗获批上市,为抗击疫情扩充“武器库”,补充“弹药”。
五是密切关注新冠病毒流行株的变化情况,指导督促企业开展相关研究,及时调整研发策略,鼓励开展针对变异株新冠病毒疫苗研发并提供技术指导,为后续疫情防控提供支撑。
六是督促新冠病毒疫苗上市许可持有人,落实主体责任,完成附条件批准时要求的各项相关任务,持续深化对附条件上市产品安全性特征的认识。
七是积极参加WHO、国际药品监管机构联盟(ICMRA)等组织召开的视频电话会议,共同探讨研发与评价标准,推动我国新冠病毒疫苗研发注册标准与国际接轨,为中国新冠病毒疫苗走向世界打下了坚实基础,为助力全球抗疫贡献了宝贵的中国药监智慧、中国药审力量。截至2021年底,药审中心累计派员参加WHO相关会议71场,参加ICMRA相关会议49场。
在高效完成应急审评工作的同时,药审中心及时梳理应急审评中好经验好做法,完善现有审评工作流程,探索制定加快创新药上市申请的工作机制和程序,加快新药新疫苗上市,不断满足人民群众的健康需求。
第七章 持续深化审评审批制度改革
(一)多措并举满足儿童用药临床急需、促进儿童用药研发创新
“支持研发严格监管儿童药”是国家局党史学习教育“我为群众办实事”实践活动“药品监管惠企利民十大项目”之一。为切实解决人民群众“急难愁盼”的用药问题,药审中心多措并举,精准发力,谋划解决儿童用药研发重点、难点问题,鼓励和促进儿童用药的研发创新,不断满足临床需求。
创新儿童用药审评管理工作机制。药审中心成立儿童用药专项领导小组和工作小组,形成任务统一部署、力量统筹调配、工作一体推进的工作格局,有效提高了发现问题、解决问题的能力。
深入调研,协调各方共破儿童用药难题。解决儿童用药难的问题,需要监管部门、临床机构和药品生产企业同向发力。药审中心多次前往国家儿童医学中心和科研企业进行调研座谈,以临床需求为导向共同研究和解决儿童用药研发、使用和审评中的技术问题,提升我国儿童用药研发和科学监管水平。
落实儿童用药优先审评审批政策,提高儿童用药安全性和可及性。药审中心坚持“高标准、严要求、强服务”的原则,借鉴新冠病毒治疗药物等应急审评审批经验,在审评系统中设立“儿童用药”特殊标识,优化审评资源配置,专人对接,加快儿童用药上市速度。2021年共有24件适用于儿童的药品上市许可申请通过优先审评审批程序获批上市。
完善儿童用药审评标准体系,指导科学研发。药审中心按照“急用先行”的原则,结合临床实际、借鉴国际经验、集中专家智慧、大胆探索实践,建立了包含真实世界数据支持等指导原则在内的儿童用药研发审评证据体系。截至2021年底共发布了《儿童用药(化学药品)药学开发指导原则(试行)》《真实世界研究支持儿童用药物研发与审评的技术指导原则(试行)》《注意缺陷多动障碍(ADHD)药物临床试验技术指导原则》等12项儿童用药专项指导原则,完善了儿童用药临床试验和安全性评价标准,为研发和审评提供了重要技术支持与审评依据,激发了企业研发活力,更好地指导了儿童用药的科学研发。
开展已上市药品说明书中儿童用药信息规范化增补工作,保障儿童临床科学用药。药审中心着力改善儿科临床中普遍存在的超说明书使用现状,破解“儿童吃药靠掰,用量靠猜”的困局。会同国家儿童医学中心及其医联体成员单位,设立“中国儿童说明书规范化项目”,充分利用儿童医疗机构数据资源,采用真实世界研究方法,筛选出建议修订说明书的品种名单和具体修订内容,现已公布两批修订说明书的品种名单。
加强儿童用药的政策宣传与培训力度。药审中心于2021年6月1日在网站开设了“儿童用药专栏”,及时公布与儿童用药相关的政策法规、指导原则、培训资料、品种批准信息等内容,集中展示了我国儿童用药审评工作,加强政策解读和宣传。人民日报刊发了《多举措鼓励儿童用药研发生产——满足用药需求
保障用药安全》,中国医药报社刊发了《全力破解儿童用药短缺难题》。
(二)完善临床试验管理制度、提高药物临床研究质量
1.发布《中国新药注册临床试验现状年度报告(2020年)》
为全面掌握中国新药注册临床试验现状,及时对外公开临床试验进展信息,为新药研发、资源配置和药品审评审批提供参考,药审中心根据药物临床试验登记与信息公示平台的新药临床试验登记信息,首次对中国新药注册临床试验现状进行全面汇总分析,发布了《中国新药注册临床试验现状年度报告(2020年)》。
药审中心将以中国新药注册临床试验登记数据为依托,聚焦监管创新,提高监管效能,在推动药品监管能力现代化中加强与业界沟通交流,增加信息透明度,助推中国新药临床试验高质量健康发展。
2.强化新冠病毒疫苗、治疗药物的临床试验进展和安全监管工作
药审中心严格按照新冠病毒疫苗、治疗药物临床试验过程中监管的工作要求,调整优化安全性监管措施,实施高频次的药物警戒及安全风险监管工作,加强对重点品种的安全监测与风险处理。截至2021年底,获准开展临床试验的82个新冠病毒疫苗、治疗药物均被纳入临床试验安全风险管理的专用通道。
3.推动《药物警戒质量管理规范》落地实施
《药物警戒质量管理规范》自2021年12月1日起正式施行,药审中心参与了该规范及其配套文件的制定以及规范的宣贯培训和技术解读工作,提高申请人对药物警戒的主体责任意识,助推《药物警戒质量管理规范》落地实施。
4.逐步完善临床试验期间药物警戒及安全风险管理工作
药审中心紧跟国际药物警戒新动态,结合中国实际,不断完善药物警戒工作的新理论、新方法和新工具,积极构建药物警戒学科发展的监管科学体系和工作平台。一是优化安全信息审评程序,构建临床试验期间安全风险管理系统(CTRiMS),实现了安全信息检测和风险处理的电子化管理,增加临床试验期间安全风险管理的协调性、有序性、规范性。二是升级符合E2B(R3)区域实施要求的药物警戒接收系统,提升安全数据库应用功能,推进ICH
E2B(R3)和ICH
E2A指导原则在我国的转化实施。三是优化安全风险管理机制,组建安全信息监测小组,对安全信息进行监测、识别、分析与初步评估,形成风险处理意见。四是形成临床试验安全信息的三级风险处理方式,即临床试验风险管理告知信、临床试验风险控制通知书、暂停或终止临床试验通知书,持续强化药物临床试验期间安全信息报告评估管理。
5.安全信息的风险识别能力稳步提高
2021年收到国内临床期间可疑且非预期的严重不良反应(SUSAR)首次报告7197份,同比增长54.51%;收到研发期间年度安全性报告(DSUR)2568份,同比增长42.82%。临床试验登记平台登记信息15075条(包括首次登记和信息更新登记),同比增长22.95%。发出临床试验风险管理告知信86份、临床试验风险控制通知书21份,暂停临床试验通知书1份,建议申办者主动暂停临床试验5次。
新冠病毒疫苗和新冠病毒治疗药物均采用快速推进的研发模式,存在一定程度的潜在风险,且临床试验开展过程中短时间纳入大量受试者。药审中心始终将新冠病毒疫苗、新冠病毒治疗药物的安全性放在首位,对新冠病毒疫苗、新冠病毒治疗药物临床试验加大安全监管力度、提高安全监管频次、加强风险预警、提升安全监管的灵活性,对警戒信息第一时间进行处理,严守安全底线。确保了临床试验风险可控、受试者安全,尽早满足了公众对新冠病毒疫苗和新冠病毒治疗药物用药安全的需求。
(三)建设中国上市药品专利信息登记平台
为贯彻落实《中共中央办公厅、国务院办公厅关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)和《国家局、国家知识产权局关于发布〈药品专利纠纷早期解决机制实施办法(试行)〉的公告》(2021年第89号),探索建立药品专利纠纷早期解决机制,对符合药品专利纠纷早期解决机制的品种,依法设置等待期、专利保护期或市场独占期。药审中心建设了中国上市药品专利信息登记平台。
1.以问题为导向,充分聆听社会各界意见建议
药审中心加强沟通协调,多次邀请相关部门、业界专家召开平台建设研讨会,汲取行业专业性意见,及时发现解决问题,推进平台建设。在中国上市药品专利信息登记平台测试期间,根据社会各界反映的问题,逐一解答并同步优化平台功能。
2.发布操作指南等文件,提高用户的平台使用体验
药审中心发布《中国上市药品专利信息登记平台用户操作指南》《中国上市药品专利信息登记填表说明》等指导性文件,给予申请人明晰指导。2021年有325个上市许可持有人登记专利信息1476条,涉及药品1090个;公开专利声明959个,其中一类申明783个,二类申明65个,三类申明175个,四类申明97个,实现药品注册相关专利信息公开。
(四)扎实推进仿制药一致性评价工作
1.持续开展参比制剂遴选工作
药审中心根据《药审中心化学仿制药参比制剂遴选工作流程》要求,继续规范遴选工作流程,有效提高工作效率,按时限完成参比制剂遴选工作。自2017年8月开展一致性评价工作以来共发布参比制剂目录49批,涉及4677个品规(1967个品种),其中包括注射剂参比制剂1253个品规(477个品种)。2021年发布参比制剂850个品规(527个品种)。
2.继续完善优化一致性评价工作
2021年已通过一致性评价331个品种。为了更好的开展一致性评价工作,药审中心完成了我国上市化学药品相关数据的梳理工作,对临床价值明确无原研对照的品种、国产创新品种、我国特有品种等进行了分析研究,为下一步一致性评价工作提供了参考。2021年制定了75个品种的药学研究技术要求,起草了27项生物等效性个药指导原则,逐步完善了审评标准体系。同时,药审中心召开一致性评价企业座谈会,充分听取企业提出的相关意见和建议,以企业关心的痛点难点问题作为下一步工作的重点。
3.优化一致性评价专栏
在药审中心网站中优化了“仿制药质量与疗效一致性评价”专栏,设专人对一致性评价专栏进行更新和维护,及时更新通过一致性评价的口服固体制剂品种说明书、企业研究报告及生物等效性试验数据、参比制剂目录、政策法规、技术指南等信息。
(五)提高药品审评审批透明度25
一是加大审评信息公开力度,建立审评信息公开的长效机制。药审中心制定《药审中心技术审评报告公开工作规范(试行)》,发布《2020年度药品审评报告》,提高审评工作透明度。截至2021年底,已累计公开新药技术审评报告500个。二是持续推进审评信息公开。在药审中心网站增设“突破性治疗公示”等栏目,对申请人关注度高的加快品种信息予以公开,同时上线异议解决系统,开通对审评结论提出异议的通道,及时回应社会关切。三是不断加强信息化建设。对药审中心网站进行升级改造。新增“儿童用药”、“行政受理服务”、“指导原则”、“药品电子通用技术文档(eCTD)”等专栏,增强审评信息公开的主动性,信息检索的便利性和信息更新的时效性,不断满足公众和申请人诉求。四是深化“放管服”改革,加快实现“一网通办”,推进药监服务事项整体联动。以建设整体联动、高效便民的网上服务平台为目标,整合内部账户体系,对接国家局网上办事大厅,做到统一账户、入口和登录。
2021年公开已承办的注册申请信息11546条,公示纳入优先审评品种信息112个,公示纳入突破性治疗品种信息51个,公示沟通交流申请信息3757个,公开批准临床默示许可申请信息2873个,公开上市药品审评报告信息184个。公开登记审查通过、受理通过的原料药、药用辅料和药包材任务2524个。2021年首次实现原料药审评进度查询,并实现与关联制剂的关联查询,公开单独审评原料药进度任务927个及与关联制剂的关联查询任务443个,持续推进审评进度公开。
(六)推动药品注册申请申报电子化
为推进药品注册申请电子申报,提高“互联网+药品监管”服务效能,eCTD项目正式实施。一是发布技术规范,指导申请人准备eCTD申报资料。制定eCTD技术规范、实施指南等技术文件,为申请人准备电子申报资料提供技术指导和标准遵循。二是开展宣贯工作,提高申请人开展eCTD申报的积极性。制定宣讲解读计划,开展对外宣讲,帮助申请人理解eCTD技术要求和申报流程。三是做好相关信息化建设,方便申请人开展eCTD申报。建设eCTD专栏,集中公开国内外指导原则、工作动态等,建设eCTD申报系统,对接国家局药品业务应用系统,打通药品注册申请全流程电子化通道。四是开展信息安全评估,提高信息安全性。开展eCTD等级保护测评、密码应用安全性评估测评、网络安全风险评估等,多措并举,有效控制和降低信息安全风险。
第八章 支持推动中药传承创新发展
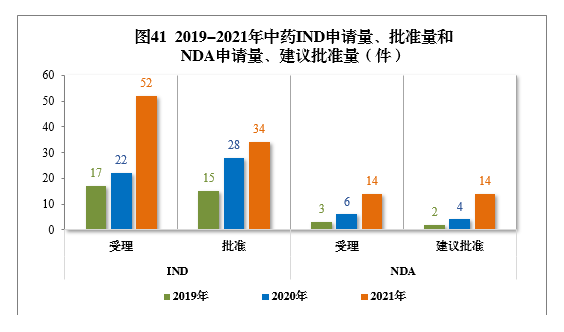
2019-2021年,中药IND申请量(17件、24件、52件)、批准量(15件、28件、34件)和NDA申请量(3件、6件、14件)、建议批准量(2件、4件、14件)均呈现连年增长的态势。2019-2021年中药IND申请量、批准量和NDA申请量、建议批准量详见图41。
(一)落实改革完善中药审评审批机制要求,推动构建“三结合”26注册审评证据体系
认真落实《中共中央
国务院关于促进中医药传承创新发展的意见》和习近平总书记关于改革完善中药审评审批机制指示精神,按照传承精华、守正创新、高质量发展的原则,深刻研究总结中药审评审批实践经验和药品审评审批制度改革成果,结合中药特点和研发实际情况,积极主动研究中药注册分类调整意见,加快构建“三结合”注册审评证据体系,畅通了中药新药的注册途径。
基于“三结合”注册审评证据体系,制定审评标准和指导原则。针对“三结合”注册审评证据体系下研究策略、方法的调整和沟通交流关注点,将目前已形成的人用经验的共识转化到指导原则之中,发布了《中药新药复方制剂中医药理论申报资料撰写指导原则(试行)》《古代经典名方中药复方制剂说明书撰写指导原则(试行)》。选择恶性肿瘤、慢性胃炎、胃食管反流病3个具体适应症为突破口,引入真实世界研究等新工具新方法,与中医临床相关适应症领域的权威专家一起针对符合中医药特点的临床疗效评价技术要求进行研究,逐步形成指导原则。
(二)研究优化注册分类,开辟古代经典名方中药复方制剂研发与审评新路径
药审中心对现行《药品注册管理办法》中药分类中的第3类“古代经典名方中药复方制剂”进行了系统研究,基于“三结合”注册审评证据体系思维,增加了“3.2类其他来源于古代经典名方的中药复方制剂”分类,并提出了一系列与之相适应的注册管理要求。该分类体现了传承精华、守正创新的原则,有别于中药创新药的研发模式,对于加快来自中医长期临床实践传承下来的经典名方、名老中医经验方以及医院制剂等的成果转化,充分满足中医临床治疗需求,具有十分积极的意义。通过“三方”相关品种的审评,实践了与该分类相适应的审评程序、临床及药学审评要点和技术要求,得到了中医药院士、国医大师等权威专家的高度赞扬。
按照国家局、国家中医药管理局工作部署,药审中心持续推进古代经典名方中药复方制剂专家审评委员会的组建工作。
(三)持续加强标准研究,构建符合中药特点的全过程质量控制体系
遵循中医药理论、传统用药经验和中药研发规律,深入研究中药特点和中药审评标准,建立完善中药新药全过程质量控制体系,制定符合中药特点的研究和评价技术指导原则,转变中药“唯成分”的质量控制理念,基本构建涵盖药材、饮片、制剂等的中药新药全过程质量控制体系和全生命周期管理的有关要求。发布了《中药新药质量研究技术指导原则(试行)》,该指导原则一方面重视中药临床长期使用证明安全、有效的事实,以临床价值为导向,尊重中医药传统和特色,引导生产企业制定符合中药特点的质量控制方法和策略;另一方面强调“质量源于设计”、“全过程质量控制”等理念,指导生产企业更加有效地控制产品质量。
深入研究、总结近几十年来中药变更研究以及中药变更监管的经验和成果,破除“唯成分”的评价方式,基于生产过程、人用经验和质量评价,构建了新的变更研究评价标准,发布了《已上市中药药学变更研究技术指导原则(试行)》,优化已上市中药药学变更技术要求,解决长期困扰企业的难点痛点问题,推动中药产业高质量发展。
(四)加强对申请人的指导,加快确有临床价值的中药新药审评
药审中心将具有明显临床价值的中药新药纳入优先审评审批程序。通过问询式沟通交流、专业问询、线上视频会议等多种方式,主动与申请人就针对关键技术问题的沟通交流,使申请人在专家咨询会上答辩更为聚焦,提高了补充资料以及说明书、质量标准等审评所需文件撰写的质量和效率。全力以赴加快中药上市许可申请审评,发挥中医药在疾病防治中的独特优势。
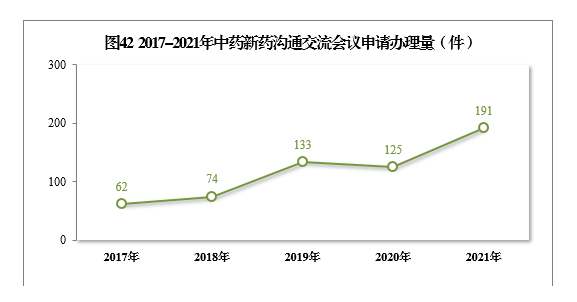
自《药物研发与技术审评沟通交流管理办法》发布以来,中药新药沟通交流会议申请的办理量不断增加,从2017年62件、2018年74件,增加至2019年133件、2020年125件、2021年191件。通过与申请人的沟通交流,前置处理申报资料存在的问题,提高了申报资料质量和审评工作效率。2017-2021年中药新药沟通交流会议申请办理量详见图42。
(五)积极做好援疆援藏工作,支持促进民族药发展
按照国家局的部署和工作要求,药审中心多次赴新疆、西藏等民族地区开展调研、培训、座谈,深入了解民族药研发实际情况和存在的问题,探索调整民族药注册管理思路,推进具有民族药临床治疗优势药物的研发。通过线上答疑等方式解答新疆、西藏民族药企业咨询问题数百条,及时解决申请人在研发和注册过程中的问题。积极推动民族药品种的研发,优先配置审评资源、加强注册服务指导、做好审评全过程的沟通交流。
第九章 审评体系和审评能力现代化稳步提升
(一)保障连任ICH管委会成员相关工作
ICH工作办公室为保障国家局成功连任ICH管委会成员,一是争取各ICH成员的理解和支持,积极筹办“ICH中国进程与展望会”,向国际行业协会全面展示了我国ICH工作成果;组织参加了药品信息协会(DIA)中国年会ICH主题日活动,围绕推动ICH国际协调等议题与来自欧美日机构代表进行深入交流;与日本监管机构联合举办研讨会,全面深化与国际监管机构和工业界的交流合作。二是提高在行业代表领域的宣传力度,2021年4月28日举办了“ICH指导原则实施情况宣讲会”,线上观看直播人数达1.4万人次,回放1.1万人次。三是密切关注ICH管委会选举进程,深入研究,积极筹备ICH管委会选举申请材料,为国家局成功连任ICH管委会成员奠定了坚实的基础。2021年6月3日国家局再次当选ICH管委会成员。
(二)积极推动ICH指导原则转化实施和议题协调工作
一是ICH工作办公室进一步推动ICH指导原则在国内的落地实施,2021年报请国家局发布ICH指导原则实施适用公告6个,明确了9个ICH指导原则的实施时间节点。截至2021年底,国家局已充分实施ICH指导原则53个,实施比例达84.13%。二是ICH工作办公室深入参与ICH议题协调工作。目前ICH共有活跃议题28个,向ICH议题协调专家工作组选派专家53人次,共参加工作组电话会累计达379次。
(三)流程导向科学管理体系建设更加科学
在中央纪委国家监委驻市场监管总局纪检监察组及国家局党组的支持和指导下,药审中心科学管理体系8个子课题的试点建设运行良好,科学管理体系制度计划制修订28个,已发布制度17个,58项改革措施稳步推进。2021年药审中心内部审评以流程为导向的科学管理体系基本建成,制度标准体系和风险防控机制进一步完善、审评流程更加清晰、审评审批效率明显提高、服务意识显著增强、服务对象满意度和社会美誉度明显提高,以问题为导向、流程为主线、制度建设为抓手的药品审评审批工作体系基本形成。同时,药审中心总结流程导向审评体系的建设成果,对《药品技术审评质量管理规范》(GRP)进行了修订。以此为新起点,按照推进治理体系和治理能力现代化新要求,药审中心将继续发挥以流程导向科学体系建设工作机制作用,坚持问题导向,不断发现新问题,研究新措施,持续推进审评体系和审评能力现代化。
(四)人才队伍建设迈出坚实步伐
药审中心积极开展人才队伍建设,树立鲜明用人导向,坚持严管和厚爱结合、激励和约束并重,鼓励工作人员锐意进取、担当作为。一是持续加强审评队伍和能力建设。积极协调增加人员编制,立足审评需要做好人才引进工作,充实专业审评力量,持续开展员工教育培训,提高工作能力。二是畅通员工职业发展通道。做好高级职称评审申报,积极开展专业技术岗位评审聘任、主审审评员选聘,做好中级职称以及管理岗位级别认定工作,破除人才职业发展瓶颈。三是不断加强制度建设,制定《员工辞职管理办法》《职工兼职(任职)管理办法》《考勤与休假管理办法》《因私出国(境)管理办法》等11个制度,夯实了人才队伍管理的基础。四是完善绩效考核等措施,进一步规范各类人员激励和约束机制。
(五)指导规范药品分中心开展审评工作
设立药品审评检查长三角分中心、药品审评检查大湾区分中心(以下简称药品分中心)是党中央、国务院在长三角区域、粤港澳大湾区推进更高起点深化改革和更高层次对外开放等战略部署和发展规划的重要举措,是对药品审评改革创新和药品审评能力建设的强化支持。药审中心在国家局的统一领导下,坚决贯彻国家区域战略,认真落实“统一审评团队、统一业务管理、统一审评系统、统一审评标准”要求,大力加强药品分中心建设工作的规划设计、建设运行及支持保障,加大业务支持指导力度,加强业务培训,推动药品分中心尽快发挥应有作用,助力区域医药产业高质量发展。
一是建立药品分中心业务工作协调机制。药审中心成立专项工作组,专题研究推进药品分中心业务开展、人才队伍建设等工作,全力推进药品分中心逐步开展审评工作。二是多种形式组织培训。药审中心通过线上培训、线下一对一带教等形式,对药品分中心人员开展了涵盖审评任务管理、专家会议、沟通交流、技术审评等方面的业务培训,促进药品分中心人员审评业务能力的提升。三是支持指导药品分中心开展沟通交流相关工作。针对具有临床价值的重点品种,药审中心给予技术支持,支持药品分中心对区域内申请人开展指导和交流工作,2021年共组织沟通交流会议17次;发布《国家药品监督管理局药品审评检查长三角分中心、大湾区分中心关于启动一般性技术问题解答工作的通知》,开通申请人向药品分中心提交一般性技术问题端口,指导药品分中心解答一般性技术问题咨询1415个。四是开展上市后变更研讨会和培训。在上海和深圳召开了“药品上市后变更类别确认研讨会”,建立药审中心与药品分中心、省级药监局关于上市后变更分类确定的沟通协调机制。选派人员前往2个药品分中心开展药品上市后变更指导原则的培训,长三角区域约两千人参加培训,粤港澳大湾区约五百人参加培训。
两个药品分中心挂牌运行以来,主动服务,深入调研了解区域内药品企业服务需求,积极解决企业新药研发与注册中遇到的突出问题。后续药审中心将会同两个药品分中心进一步深化审评审批制度改革,有效提升药品分中心服务区域医药产业创新发展的工作质量,指导支持药品分中心推动建设政治过硬、素质优良、高效廉洁的审评人才队伍。
第十章 加快完善药品技术指导原则体系
近年来,随着医药产业迅猛发展,新技术、新靶点、新机制、新成果不断涌现,药品注册申报数量持续增加,大批创新型高科技药物进入注册审批程序。为满足药品更新换代速度和医药行业发展需求,药品技术指导原则在具有规范性、指导性和应用效果的同时还必须具有前瞻性。药审中心以满足药物研发需求和鼓励创新为目标,持续推进审评体系和审评能力现代化建设,致力于构建科学权威公开的审评标准体系,解决影响和制约药品创新、质量、效率的突出问题。
根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,药审中心加大指导原则的起草制定力度,2021年经国家局审查同意发布了87个指导原则。开展药品审评标准体系建设以来,已累计发布了361个指导原则,覆盖中药、化学药、生物制品等领域,包含新冠病毒治疗药物、古代经典名方、细胞和基因治疗等研发热点难点问题。目前国内指导原则已基本形成技术标准体系,为医药产业的创新发展和药品审评提供了科学有力的技术支撑。2021年药审中心完成的技术指导原则详见附件7。
在加速推动新冠病毒治疗药物研发上市方面,药审中心发布了《新型冠状病毒中和抗体类药物非临床研究技术指导原则(试行)》《抗新冠病毒肺炎炎症药物非临床药效学研究与评价技术指导原则(试行)》《抗新冠病毒化学药物非临床药效学研究与评价技术指导原则(试行)》等指导原则,紧跟国内国际新冠肺炎疫情的发生发展及临床治疗需求,以新冠病毒中和抗体类药物、抗新冠病毒肺炎炎症药物和抗新冠病毒化学药物作为抗疫药物研发和审评审批的重点,更好地指导相关药物的研发。
在支持推动中药传承创新发展方面,发布了《古代经典名方中药复方制剂说明书撰写指导原则(试行)》《中药新药复方制剂中医药理论申报资料撰写指导原则(试行)》《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》等指导原则,加快构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,规范中医药理论申报资料和古代经典名方中药复方制剂说明书相关内容的撰写。
在满足儿童用药临床急需、促进儿童用药研发创新方面,发布了《儿童用化学药品改良型新药临床试验技术指导原则(试行)》《化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(试行)》等指导原则,鼓励药物研发者研发适宜儿童使用的剂型和规格,同时通过完善药品说明书中儿童用药信息以指导临床合理用药,持续解决临床儿童用药紧缺问题。
在细胞和基因治疗方面,发布了《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》《基因治疗产品非临床研究与评价技术指导原则(试行)》《基因治疗产品长期随访临床研究技术指导原则(试行)》等指导原则,规范了国内细胞和基因治疗药物的研究与评价,进一步提高企业研发效率,引导行业健康发展。
在肿瘤药物研发发面,发布了《以临床价值为导向的抗肿瘤药物临床研发指导原则》《生物标志物在抗肿瘤药物临床研发中应用的技术指导原则》《抗肿瘤药首次人体试验扩展队列研究技术指导原则(试行)》等指导原则,从患者需求的角度出发,对抗肿瘤药物的临床研发提出建议,以期指导医药企业在研发过程中,落实以临床价值为导向、以患者为核心的研发理念,促进了抗肿瘤药物科学有序的开发。
在罕见病治疗方面,发布了《罕见疾病药物临床研发技术指导原则》,意在促进更多低发病率疾病为对象的药物研发,展现了药审中心推动我国罕见疾病药物研发的信心和决心,力争将更多原先被市场冷落的罕见疾病药物拉入研发快车道,为边缘化的罕见病患者带来更多希望的曙光。同时针对罕见病药物研发积极性较低的突出问题,促使医药企业围绕尚未满足的临床需求,将罕见病作为创新产品研发的重要方向之一。而最终目的,是为了推动我国罕见病防治与保障迈上新的台阶,为罕见病患者提供更优质的诊疗服务,保障人民的健康权益。
在真实世界数据方面,发布了《用于产生真实世界证据的真实世界数据指导原则(试行)》,从审评角度明确了用于回答临床科学问题的数据要求,强调了真实世界数据不等同于真实世界证据,为工业界利用真实世界数据支持药物研发提供了科学可行的指导意见。该指导原则的发布,使我国真实世界数据研究在政策监管层面迈向全球第一梯队。
在药品上市后变更方面,发布了《已上市中药药学变更研究技术指导原则(试行)》《已上市化学药品药学变更研究技术指导原则(试行)》《已上市生物制品药学变更研究技术指导原则(试行)》等指导原则,旨在落实药品全生命周期管理,指导我国已上市中药、化学药品和生物制品药学的变更研究,为申请人提供可参考的技术标准。
指导原则的制定与发布进一步完善了药品审评体系,为科学公正的审评决策提供了有力的技术支撑。同时,鼓励科研机构、申请人和行业协会更多地参与药品指导原则编制工作,使药品指导原则体系构建工作形成良性循环,进而更好的推动我国药品指导原则体系更加完善。
第十一章 党风廉政建设见行见效
药审中心以习近平新时代中国特色社会主义思想为指导,增强忠诚拥护“两个确立”,坚定践行“两个维护”的政治自觉,以落实管党治党政治责任的有力成果,为推进药品审评改革创新提供了坚强政治保障。
一是认真开展好党史学习教育。制定《药审中心党委开展党史学习教育实施方案》,召开动员部署大会,成立督导组指导各党支部利用“三会一课”、组织生活会等多种形式推进党史学习教育。
二是积极开展好“我为群众办实事”实践活动。围绕公众和申请人急难愁盼的现实问题,将国家局“药品监管惠企利民十大项目”中涉及药审中心为责任单位的4个项目作为工作重点认真抓好落实,确立了加快推进新冠病毒疫苗审评、鼓励儿童药研发创新、推进审评信息公开、不断优化沟通交流机制、持续提升服务申请人质量等25个办实事项目,不断满足业界和公众诉求。
三是统筹抓好中央、国家局党组巡视整改及违反中央八项规定精神专项治理各项工作,通过建章立制、优化流程、加强督办等手段协调并推动解决整改过程的难点堵点问题。通过巡视整改不断提升整体工作水平。
四是开展重点任务专项监督。对疫情防控、原辅包关联审评审批、新冠病毒疫苗审评审批等落实情况进行重点监督,推动药品审评制度改革重要工作落地见效。对于审评暂停品种的暂停原因、纳入突破性疗法程序的品种依程序沟通交流执行情况等开展常态监督,着力防范化解风险隐患,压实责任。
五是持续防范和化解廉政风险。落实上级纪检组织关于“行贿受贿一起查”要求,制定药品注册申请人行为合法合规承诺书。组织员工进行利益冲突情况报告,开展员工经商办企业持股清查工作,推动建设清正廉洁的审评审批环境。
六是坚持警示教育常态化。制定年度廉政文化建设方案,每两月编印1期《廉洁审评教育专刊》,每月向全体员工推送廉洁警句,大力营造崇廉尚廉的浓厚氛围。
第十二章 2022年重点工作安排
过去的一年间,药品技术审评工作在鼓励医药创新、维护人民健康和公共卫生安全方面作出了积极的贡献,在保障疫情防控大局和加快医药产业高质量发展中的关键性作用也愈加显著。随着药品审评审批制度改革不断向纵深推进,人民群众对药品质量和安全有着更高的期盼,医药行业对公平、有序、可预期的审评环境的诉求更加强烈,以及在全球公共卫生危机频发、“全球新”药物创新性不断提升等复杂的社会背景下,我国药品审评机构、药品审评能力和药品审评体系现代化方面依然面临着诸多挑战。
一是审评队伍规模与审评任务量匹配失衡。目前,审评队伍力量与每年按时限审评上万件注册申请任务量之间的矛盾依然突出,加班加点审评仍是常态。二是药品审评能力现代化水平仍需全面加强。随着新药研发创新全球化不断提升,新机制、新靶点等“全球新”的药物逐渐增多,创新产品对审评能力的挑战和压力已日渐凸显。三是如何更好地强化药品审评效能、提升为人民服务水平、建立健全现代化药品审评体系的问题变得更加突出。
2022年,药审中心将在国家局党组的坚强领导下,紧密围绕各项重要工作部署,主要开展以下方面的工作。
(一)全力保障新冠病毒疫苗药物审评
服务疫情防控大局,全力保障新冠病毒疫苗扩产能、保质量、保供应;严守药物研发安全有效标准,坚持提前介入、研审联动、科学严谨、依法合规,全力以赴推动新冠病毒疫苗和治疗药物上市,持续跟进各技术路线疫苗药物品种研发进展,加快促进重点药物研发创新,督促附条件上市疫苗药物生产企业开展上市后研究;总结固化好的经验做法,优化应急审评工作机制,促进应急审评工作经验转化实施;加强新冠应急审批药物临床试验进展与安全信息监管。
(二)持续深化药品审评审批制度改革
促进医药产业基础性研究,支持鼓励企业在现代医药新技术、新靶点、新机制方面开展创新,促推解决产业创新发展的“卡脖子”问题;坚持鼓励以临床价值为导向的新药好药、罕见病用药、重大传染病用药、公共卫生方面的临床急需药品研发创新;细化优化突破性治疗药物、附条件批准、优先审评审批程序,促进药品高质量发展;支持满足临床需求的儿童用药研发创新,提高儿童用药的安全性和可及性;巩固按时限审评改革成果,完善审评任务管理机制;强化“放管服”意识,提升沟通交流服务质量;优化药物临床试验默示许可制度;完善专家咨询委员会工作制度;加强药品注册核查检验沟通协调,做好《药品注册核查检验启动工作程序》配套制度落地实施;加强临床试验期间的药物警戒体系建设,提升临床试验信息管理能力;稳步推进eCTD工作,提升电子化管理水平。
(三)加快推动中药审评审批机制改革
完善中药审评审批机制,加快构建以中医药理论、人用经验和临床试验相结合的中药审评体系;推进中药技术指导原则制修订,建立完善符合中药特点的审评体系,促进中药传承创新发展;加快组建古代经典名方中药复方制剂专家审评委员会。
(四)扎实推进仿制药质量和疗效一致性评价
坚持标准不降低,有序推进口服固体制剂、注射剂一致性评价工作;严格评价标准,完善相关技术指导原则体系;优化一致性评价流程,加快参比制剂遴选工作,推进无参比制剂品种梳理及国产创新药自证工作。
(五)全面开展审评体系和审评能力现代化建设
做好药品安全专项整治配合工作;在国家局统一领导下加快推进药品长三角分中心、药品大湾区分中心业务等方面建设;持续推进流程导向科学管理体系建设,完善科学审评体系,规范权力运行,防范各类风险;加强长效机制建设,加快将科学管理体系的建设成果转化为规章制度落地落实,提升审评科学化水平,不断提升审评质量和审评效率;做好疫苗国家监管体系(NRA)评估迎检;推进以临床价值为导向的指导原则建设;推进ICH指导原则转化实施,促进国内行业监管与国际标准接轨;推进监管科学课题研究;加强法务工作,提升职工法律意识和依法决策水平;充实审评力量,优化专业结构,加强审评队伍建设;加强业务培训,探索完善培训考核与评价机制。
(六)驰而不息强化党风廉政建设
持之以恒学深悟透做实习近平新时代中国特色社会主义思想,认真学习党的二十大精神,深刻认识“两个确立”的决定性意义,坚决贯彻习近平总书记的重要讲话、重要指示精神,不断增强“四个意识”,坚定“四个自信”,做到“两个维护”;认真贯彻党中央、国务院重大决策部署,巩固落实中央八项规定精神;持续推进“不敢腐、不能腐、不想腐”体制机制建设;做好防范利益冲突工作;丰富新闻宣传方式,打造系统化宣传格局,弘扬药品审评审批制度改革成果。
结 语
行之力则知愈进,知之深则行愈达。2022年,药审中心将继续以习近平新时代中国特色社会主义思想为指导,认真贯彻落实习近平总书记重要指示批示、党的十九大和历次全会精神,深刻领会“两个确立”的决定性意义,增强“四个意识”,坚定“四个自信”,坚决做到“两个维护”,以革故鼎新的勇气、坚忍不拔的定力,抓好“十四五”药品安全及高质量发展规划的贯彻落实,全面加强党的建设,纵深推进全面从严治党,持续深化药品审评审批制度改革,深入开展药品安全专项整治行动,不断加大审评队伍建设管理力度,扎实做好新冠病毒疫苗药物应急审评工作,大力支持中医药传承创新发展,有序推进仿制药质量和疗效一致性评价,不断提升药品审评体系和审评能力现代化水平,全力服务疫情防控工作大局,切实保障人民群众用药安全有效可及。
以初心,致创新。做好药品审评工作使命光荣、责任重大。药审中心将更加紧密团结在以习近平同志为核心的党中央周围,把握大势、抢占先机,肩负起新时代赋予的重任,心怀“国之大者”,以不负人民的实际行动奋力开创药品审评事业新局面,加快建设科学、高效、权威、公众信赖的药品审评机构,以优异成绩迎接党的二十大胜利召开,为守护人民生命健康和建设社会主义现代化国家、实现中华民族伟大复兴的中国梦作出新的更大贡献!
注解:
1此数据包含以医疗器械作用为主的药械组合产品4件,不包含原料药;本报告中“注册申请”的数量单位为“件”,以受理号计算。
2原国家食品药品监督管理总局、现国家药品监督管理局在本报告中统称为国家局。
3包括无需技术审评的补充申请和临时进口注册申请。
4在受理需技术审评的注册申请9235件的基数上,此数据不含药械组合产品4件。
5包含民族药。
6以补充申请途径申报。药审中心自2017年8月开始承担仿制药质量和疗效一致性评价工作。
7本章创新药包含按照现行《药品注册管理办法》(国家市场监督管理总局令第27号)注册分类中药、化药、生物制品1类和原《药品注册管理办法》(国家食品药品监督管理局令第28号)注册分类中药1-6类、化药1.1类、生物制品1类受理的药品。
8本报告中“品种”的数量单位为“个”,均以通用名称计。
9化学药5.1类为境外上市的原研药品和改良型药品的境内上市。
10临床试验申请包括IND和验证性临床试验申请。
11创新化学药IND 1134件(487个品种),NDA 32件(21个品种)。
12创新生物制品IND 643件(423个品种),NDA 23件(16个品种)。
13药物临床试验申请、一致性评价申请、补充申请、境外生产药品再注册申请。
14自2017年5月1日,药审中心根据《国家食品药品监督管理总局关于调整部分药品行政审批事项审批程序的决定》(国家食品药品监督管理总局令第31号),开始以国家局名义对部分注册申请作出药品行政审批决定。
15本报告所称“审结”包括:完成技术审评报送国家局审批、完成技术审评后以国家局名义审批、不需要技术审评以国家局名义直接审批、审评审批程序终止。“审结”不包含已完成至少一轮技术审评,因需申请人补充资料、发出补充资料通知书的注册申请(以下简称待申请人回复补充资料)。
16含药械组合注册申请8件。
17不含药械组合注册申请8件。
18 本报告中的原研药,为通过系统完整的研究,并证明安全有效、质量可控的药品。
19根据《国家药品监督管理局、国家卫生健康委员会关于临床急需境外新药审评审批相关事宜的公告》(2018年第79号),药审中心先后遴选并发布三批临床急需境外新药名单共81个品种。
20本章创新药包含按照现行《药品注册管理办法》(国家市场监督管理总局令第27号)注册分类中药、化药、生物制品1类和原《药品注册管理办法》(国家食品药品监督管理局令第28号)注册分类中药1-6类、化药1.1类、生物制品1类审结的药品。
21药物临床试验申请、一致性评价申请、补充申请、境外生产药品再注册申请及其复审注册申请。
22无需技术审评的补充申请、临时进口注册申请。
23基于风险启动的注册核查任务不包含新冠病毒治疗药物、新冠病毒疫苗的现场核查、有因检查。
24《药审中心关于业务咨询服务联络方式的通知》见药审中心网站(www.cde.org.cn)。
25数据来源为药审中心网站“信息公开”专栏。
26中医药理论、人用经验、临床试验相结合的中药注册审评证据体系。

